浓硫酸的性质实验 知识点题库
选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓H2SO4氧化成CO2 , 下列说法正确的是( )

某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )

某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式: .
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用.
试管a中的现象是 , 作用是 .
试管b中的现象是 ,作用是 .

Ⅰ、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图1所示:
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为 .
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 .
(3)若将B中品红溶液换成溴水,通入一段时间后溴水褪色,这说明了二氧化硫具有漂白性,你是否同意这个观点 ,(填“同意”或“不同意”),说明理由 (用离子方程式表示).
Ⅱ、以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体.其过程如图2所示.
回答下列问题:
(4)配平在滤液(Ⅲ)中发生反应的化学方程式: NO2+ H2O+ O2= HNO3
(5)写出制取硫酸铜的总反应方程式: .
(6)在上述生产过程中,被循环使用的物质是 .

请回答下列问题:
(1)生成的黑色物质(单质)是 (填化学式).
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是 (填化学式),反应的化学方程式为 .
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有 (填序号).
A.酸性
B.吸水性
C.脱水性
D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液 ,说明这种气体具有 性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式: .
(5)能否用澄清石灰水鉴别这两种气体? (填“能”或“不能”),若不能,请填写两种能鉴别的试剂 .

乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
水溶性 | 易溶 | 难溶 | 微溶 |
-
(1) 加热A中三种反应物的混合物时,发生反应的化学方程式为:。
-
(2) 若选用较浓的硫酸作为反应物,得到的产品则会呈棕黄色,这说明反应过程中有生成。为去除颜色,最好选择下列的溶液来洗涤产品。
A.四氯化碳
B.硫酸钠
C.碘化亚铁
D.亚硫酸钠
产品选择上述溶液洗涤后,还需再用蒸馏水洗涤一次。洗涤液与产品分离的方法是(填方法名称)。
-
(3) 装置中,B和D两部分的作用分别是:B ;D。
-
(1) 硅是无机非金属材料的主角.玻璃是重要的硅酸盐产品之一,实验室保存
 溶液的试剂瓶不能用玻璃塞,原因可用化学方程式表示: .
溶液的试剂瓶不能用玻璃塞,原因可用化学方程式表示: . 铝制品表面有一层氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏,现要将氧化铝与氢氧化钠溶液作用,写出该反应的离子方程式:
-
(2) 生活中常用氯系消毒剂,比如漂白粉的有效成分是(写化学式),已知现榨的苹果汁中含
 ,在空气中会由淡绿色变为棕黄色,则这个变色过程中的
,在空气中会由淡绿色变为棕黄色,则这个变色过程中的  被(填“氧化”或“还原”,下同).若榨汁时加入适量的维生素C,可有效防止这种现象的发生,这说明维生素C具有性.
被(填“氧化”或“还原”,下同).若榨汁时加入适量的维生素C,可有效防止这种现象的发生,这说明维生素C具有性.
-
(3) 含硫的物质在生产和生活中有重要作用.
Ⅰ根据右图所示装置,回答下列问题.
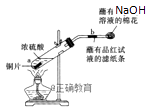
停止反应后,b处产生的现象是:;
写出a处发生反应的化学方程式:;
蘸有
 溶液的棉花的作用是:;
溶液的棉花的作用是:; -
(4) Ⅱ某化学兴趣小组选用下列装置,测定工业原料气(含
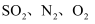 )中的
)中的  的含量.
的含量. 
若原料气的流向为从左到右,则上述装置连接的顺序是(填字母代号):原料气 →→→→→e;已知装置Ⅱ中反应为:
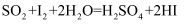 .当装置Ⅱ中出现现象时,立即停止同期.若
.当装置Ⅱ中出现现象时,立即停止同期.若  溶液的浓度为0.05
溶液的浓度为0.05  ,体积为20mL,此时收集到的
,体积为20mL,此时收集到的  与
与  的体积为297.6mL(已经折算为标准状况下的气体体积),由此可求得
的体积为297.6mL(已经折算为标准状况下的气体体积),由此可求得  的体积分数为.
的体积分数为. -
(5) 下列试剂中,可以用来代替试管中的碘的淀粉溶液的是 (填代号).A . 酸性
 溶液
B .
溶液
B .  溶液
C . 溴水
D . 氨水
溶液
C . 溴水
D . 氨水
-
(6) Ⅲ从原子利用率,减少污染等角度考虑,下列制取硫酸铜合理的方法是 (填代号)A . 铜和浓硫酸的反应 B . 铜和稀硫酸的反应 C . 氧化铜和硫酸的反应 D . 微热下,使铜屑在持续通入空气的稀硫酸中溶解
| 选项 | 现象 | 解释 |
| A | 蔗糖变黑 | 浓硫酸具有脱水性 |
| B | 有刺激性气味 | 浓硫酸具有强酸性 |
| C | 固体体积膨胀 | 生成大量气体 |
| D | 烧杯壁发烫 | 反应放热 |
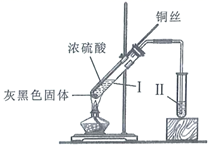
 B . 反应结束后,为观察溶液颜色需向试管Ⅰ中加入水
C . 若试管Ⅱ盛放紫色石蕊溶液,可观察到紫色褪至无色
D . 为验证气体产物具有还原性,试管Ⅱ可盛放溴水
B . 反应结束后,为观察溶液颜色需向试管Ⅰ中加入水
C . 若试管Ⅱ盛放紫色石蕊溶液,可观察到紫色褪至无色
D . 为验证气体产物具有还原性,试管Ⅱ可盛放溴水
-
(1) 可用于制作计算机芯片和太阳能电池的是(填化学式,下同),光导纤维的主要成分是。
-
(2) 形成酸雨的原理之一如下图所示:

回答下列问题:
①酸雨的pH(填“>”“<”或“=”)5.6。
②氨的催化氧化方程式。
③铵盐与强碱反应的离子方程式
-
(3) 二氧化氮溶于水的化学方程式,
-
(4) 试管①中反应的化学方程式是。

-
(5) 浓硝酸与铜反应的化学方程式为。

选项 | 实验操作和现象 | 结论 |
A | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO |
B | 向浓度均为0.1mol·L-1的MgCl2和CuCl2的混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 在MgSO4溶液中加入一小块Na,金属Na溶解,并生成固体 | 该固体为Mg |
D | 将浓硫酸滴到蔗糖表面固体变黑膨胀 | 浓硫酸只表现脱水性 |

 与浓硫酸反应,只体现
与浓硫酸反应,只体现 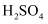 的酸性
B . a处变红,说明
的酸性
B . a处变红,说明  是酸性氧化物
C . b或c处褪色,均说明
是酸性氧化物
C . b或c处褪色,均说明  具有漂白性
D . 试管底部出现白色固体,说明反应中无
具有漂白性
D . 试管底部出现白色固体,说明反应中无  生成
生成




