探究石蜡油分解制乙烯及乙烯的化学性质 知识点题库
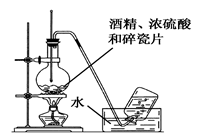
乙烯的实验室制法:

-
(1) 药品:
-
(2) 反应原理:(方程式)
-
(3) 在圆底烧瓶中放入少量碎瓷片是为了防止液体发生
-
(4) 反应中浓硫酸的作用
-
(5) 将乙烯通入酸性高锰酸钾溶液中,现象是 其反应类型是
-
(6) 将乙烯通入溴水中,现象是 ,所发生的化学反应方程式 其反应类型是
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
-
(1)
试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔.
A中残留物
 电石
电石 乙炔
乙炔 聚乙炔
聚乙炔写出反应③的化学方程式:
-
(2) 试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯代物有 种.
-
(3) 锥形瓶C中观察到的现象
-
(4) 写出C中逸出的气体在工业上的两种用途:
小强同学准备制取乙烯并探究乙烯与溴的反应(提示:在制乙烯时易生成SO2).在I至IV的仪器中盛放的药品顺序为:无水乙醇、浓硫酸;溴水;氢氧化钠溶液;品红溶液.准备的仪器如图.

-
(1) 仪器各接口顺序为
-
(2) I中无水乙醇与浓硫酸的体积比为 反应方程式为
-
(3) Ⅱ中的化学方程式是
-
(4) ⅢⅣ的作用为 .若没有这两个装置,则易发生反应的离子方程式为
某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.

-
(1) 写出该实验中生成乙烯的化学方程式:
-
(2) 甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 (填字母序号)
A、乙烯与溴水易发生取代反应
B、使溴水褪色的反应,未必是加成反应
C、使溴水褪色的物质,未必是乙烯
D、浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
-
(3) 乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是
-
(4) 丙同学对上述实验装置进行了改进,在I和II之间增加如图2装置,则A中的试剂应为 ,其作用是 ,B中的试剂为
-
(5) 处理上述实验后烧瓶中废液的正确方法是 (填字母序号).
A、废液冷却后倒入下水道中
B、废液冷却后倒入空废液缸中
C、将水加入烧瓶中稀释后倒入废液缸.
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.

-
(1) X的分子式是
-
(2) X与金属钠反应放出氢气,反应的化学方程式
-
(3) X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是
-
(4) X可以用某烃Z与水反应制备.图是石蜡油在炽热碎瓷片的作用下产生Z并检验其性质的实验,完成下列问题.
①B中反应类型是 ;
②C中实验现象是 ;
③制取氯乙烷(CH3CH2Cl)的最佳方法是(用化学方程式表示):
 备乙烯并检验,回答下列问题:
备乙烯并检验,回答下列问题:
-
(1) 写出实验室制取乙烯的化学方程式:
-
(2) 甲同学用装置一来验证有乙烯生成,乙同学认为该方法不合理,理由是:
-
(3) 随着反应的进行,丙同学观察到烧瓶中液体变黑,同时得到的气体有刺激性气味,为同时检验该具有刺激性气味的气体和乙烯,丙同学提出可用如上图所示的装置二.
①装置二试管Ⅰ中盛装试剂为 ;
②洗气瓶Ⅱ中盛装试剂为
-
(4)
已知不对称烯烃与溴化氢加成时,在不同条件下产物有主次之分:

请以2﹣丙醇、HBr为原料经过三步反应制取1﹣丙醇,其他无机试剂任选.
①
②
③
1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm﹣3 , 沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
①CH3CH2OH CH2═CH2↑+H2O
CH2═CH2↑+H2O
②CH2═CH2+Br2→CH2BrCH2Br
某化学兴趣小组用如图1所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色.
回答下列问题:

-
(1) 已知该实验的副反应之一是乙醇会被浓硫酸氧化成CO2 . 写出该反应的化学方程式:
-
(2) 甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由是 (填正确答案的标号,下同).
A.乙烯与溴水易发生取代反应 B.使溴水褪色的物质,未必是乙烯
C.使溴水褪色的反应,未必是加成反应
D.浓硫酸氧化乙醇生成的乙醛,也会使溴水褪色
-
(3) 乙同学经过仔细观察后认为试管中另一现象可证明反应中有乙烯生成,该现象是
-
(4) 丙同学对上述实验进行了改进,在Ⅰ和Ⅱ之间增加如图2所示的装置,则A中的试剂为 ,其作用是 ,B中的试剂为 ,其作用是
-
(5) 丁同学通过洗涤、蒸馏等操作对1,2一二溴乙烷粗品进行了精制.该洗涤操作用到的主要玻璃仪器是 ,该仪器在使用前须清洗干净并
石蜡油(主要是含17个碳原子以上液态烷烃混合物)分解实验按如图所进行:

-
(1) 石蜡油分解实验产生的气体的主要成分是 (填写序号,下同)
①只有甲烷
②只有乙烯
③烷烃跟烯烃的混合物
-
(2) 将石蜡油分解所得生成物通入到溴水中,现象是 ;通入到酸性高锰酸钾溶液中,现象是
-
(3) 碎瓷片的作用是 (填序号).
①防止暴沸 ②有催化功能 ③积蓄热量 ④作反应物.

-
(1) 写出该实验中生成乙烯的化学方程式:
-
(2) 甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 (填字母序号)A . 乙烯与溴水易发生取代反应 B . 使溴水褪色的反应,未必是加成反应 C . 使溴水褪色的物质,未必是乙烯 D . 浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
-
(3) 乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是
-
(4) 丙同学对上述实验装置进行了改进,在I和II之间增加如图2装置,则A中的试剂应为,其作用是,B中的试剂为
-
(5) 处理上述实验后烧瓶中废液的正确方法是 (填字母序号)A . 废液冷却后倒入下水道中 B . 废液冷却后倒入空废液缸中 C . 将水加入烧瓶中稀释后倒入废液缸.

-
(1) B中溶液褪色,是因为乙烯被。
-
(2) C中发生反应的化学方程式。
-
(3) 在D处点燃时必须进行的操作是。
 B . 实验室制氨气
B . 实验室制氨气  C . 实验室制氯气
C . 实验室制氯气 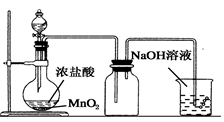 D . 实验室制乙酸乙酯
D . 实验室制乙酸乙酯 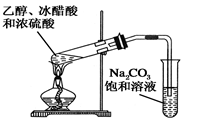
| 选项 | 实验操作和现象 | 结论 |
| A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定具有氧化性 |
| B | 将石蜡油分解产生的气体通入酸性高锰酸钾溶液中,溶液的紫红色逐渐褪色 | 石蜡油分解产生的气体中含有乙烯 |
| C | 常温下,向浓度均为0.1mol·L−1的CuSO4和MgSO4的混合溶液中逐滴滴加稀NaOH溶液,先生成蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| D | 将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液,出现白色沉淀 | 非金属性:Cl>C>Si |

-
(1) 传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g)
 C2H4(g)+H2(g) ΔH
C2H4(g)+H2(g) ΔH ①已知:298K时,相关物质的相对能量如图:则ΔH=。
②850℃,恒压条件下,常需要通入大量水蒸气,目的是。
-
(2) 乙烷氧化裂解制乙烯[主反应为C2H6(g)+1/2O2(g)
 C2H4(g)+H2O (g)]
C2H4(g)+H2O (g)] ①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g)
 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是。
2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是。②探究该反应的适宜条件,得到下图数据:

已知:C2H4的选择性:指转化的C2H6中生成C2H4的百分比;乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中
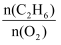 的变化情况。
的变化情况。用该方法制备乙烯应该选择的适宜条件为:温度;
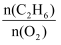 =。
=。 -
(3) 某乙烯熔融燃料电池工作原理如下图所示:则负极的电极反应式为。


-
(1) 工业制乙烯的实验原理是烷烃(液态)在催化剂和加热、加压条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷可发生如下反应,反应式已配平:
 ,
,  ,则甲的分子式为;乙的结构简式为。
,则甲的分子式为;乙的结构简式为。 -
(2) B装置中的实验现象是。
-
(3) C装置中的实验现象是,其中发生反应的反应类型是。
-
(4) 查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置(填序号)中的实验现象可判断该资料是否真实。
-
(5) 通过题述实验探究可知,检验甲烷和乙烯的方法是(填序号,下同);除去甲烷中乙烯的方法是。
A.气体通入水中
B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
-
(6) 分别燃烧乙烯和甲烷,乙烯产生黑烟,原因是。
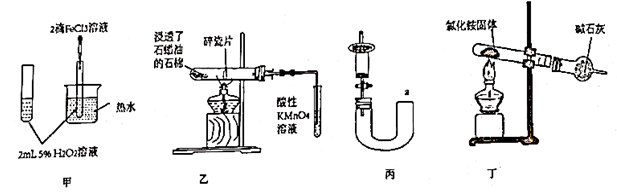
 对
对  分解反应有催化作用
B . 用装置乙验证石蜡油分解的产物只有乙烯
C . 用装置丙从a处加水的方法检验气密性
D . 用装置丁制取氨气
分解反应有催化作用
B . 用装置乙验证石蜡油分解的产物只有乙烯
C . 用装置丙从a处加水的方法检验气密性
D . 用装置丁制取氨气


-
(1) 用化学反应方程式解释B装置中的实验现象:,其反应的类型是。
-
(2) C装置中的现象是。
-
(3) 通过上述实验探究可知,检验甲烷和乙烯的方法是(填字母,下同);除去甲烷中乙烯的方法是。
A.将气体通过装酸性高锰酸钾溶液的洗气瓶
B.将气体通入氢氧化钠溶液中
C.将气体通入水中
D.将气体通过装溴水的洗气瓶
-
(4) 乙烯可以生产日常生活使用的高分子塑料,写出其反应的化学方程式。



