乙醇的催化氧化实验 知识点题库

-
(1) 用图所示的装置确证乙醇燃烧产物中有CO、CO2、H2O,应将乙醇燃烧产物依次通过以下装置,按气流从左到右的顺序填写装置编号:
-
(2) 实验时可观察到装置②中A瓶的石灰水变浑浊.A瓶溶液的作用是 ,B瓶溶液的作用是 ;C瓶溶液的作用
-
(3) 装置①的作用是 .装置③中所盛的是 溶液,作用是
-
(4) 装置④中所盛固体药品是 ,它可确证的产物是
-
(5) 尾气应

实验操作:预先使棉花团浸透乙醇并照图安装好;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。请回答以下问题:
-
(1) 被加热的铜丝处发生反应的化学方程式为。
-
(2) A管中可观察到现象。
从中可认识到在该实验过程中催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的。
-
(3) 实验一段时间后,如果撤掉酒精灯,反应(填“能”或“不能”)继续进行。原受热的铜丝处的现象是,原因是。

-
(1) 实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:,;在不断鼓入空气的情况下,熄灭酒精灯反应仍能继续进行,说明乙醇的催化反应是反应。
-
(2) 甲和乙两个水浴作用不相同。
甲的作用是;乙的作用是。
-
(3) 反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
-
(4) 试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可在混合液中加入(填写字母),然后,再通过(填实验操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳

-
(1) 实验过程中铜网出现红色和黑色交替的现象,请写出其中黑变红现象反应的化学方程式: ;在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是反应.
-
(2) 甲和乙两个烧杯中分别盛的是热水和冰水,其作用分别是:甲是;乙是。
-
(3) 反应进行一段时间后,集气瓶中收集到的气体的主要成分是。
-
(4) 若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,要除去该物质,可先在混合液中加入(填写字母)。
a.碳酸氢钠溶液
b.苯
c.氯化钠溶液
d.四氯化碳
然后,再通过(填实验操作名称)即可除去。

 D .
D . 

-
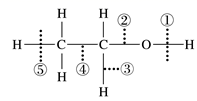
(1) B中的含氧官能团有和(填名称);
-
(2) C→D的转化属于反应(填反应类型).
-
(3) 已知E→F的转化属于取代反应,则反应中另—产物的结构简式为。
-
(4) A (C9H10O4)的一种同分异构体X满足下列条件:
I.X分子有中4种不同化学环境的氢。
II. X能与FeCl3溶液发生显色反应。
III. 1mol X最多能与4 mol NaOH发生反应
写出该同分异构体的结构简式:。
-
(5) 已知:


 +R3CHO,根据已有知识并结合相关信息.
+R3CHO,根据已有知识并结合相关信息. 写出以
 为原料制备
为原料制备  的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:CH3CH2Br
 CH3CH2OH
CH3CH2OH  CH3COOCH2CH3
CH3COOCH2CH3
① ![]() ②
②  ③
③ ![]() ④
④ 

下列说法错误的是( )
 2CH3CHO+2H2O
D . 实验结束时需先将④中的导管移出。再停止加热
2CH3CHO+2H2O
D . 实验结束时需先将④中的导管移出。再停止加热

请填写下列空白:
-
(1) 烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易发生副反应.请写出乙醇发生消去反应的方程式。
-
(2) 写出制备1,2﹣二溴乙烷的化学方程式:。
-
(3) 安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请回答发生堵塞时瓶b中的现象:。
-
(4) 容器c中NaOH溶液的作用是:。
-
(5) 判断该制备反应已经结束的最简单方法是;
-
(6) 若产物中有少量副产物乙醚,可用的方法除去;
-
(7) 反应过程中应用冷水冷却装置d,其主要目的是;
| 选项 | 实验操作和现象 | 结论 |
| A. | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的1,2二溴乙烷无色、可溶于四氯化碳 |
| B. | 向试管中加入乙醇,取一个铜丝,在酒精灯上灼烧后插入乙醇,立刻闻到刺激性气味 | 乙醇发生催化氧化反应得到了乙醛 |
| C. | 向试管中加入乙醇,向其中加入一小块新切的钠,反应剧烈,钠浮在乙醇液体表面 | 钠能与乙醇反应且钠的密度小于乙醇 |
| D. | 在试管中先加入2ml10%CuSO4溶液,再滴加5滴5%NaOH溶液,得到新制的Cu(OH)2溶液。再向其中加入少量葡萄糖溶液,加热后得到砖红色沉淀 | 葡萄糖具有还原性 |
①将乙醇和乙酸混合,再加入稀硫酸供热制乙酸乙酯
②将在酒精灯火焰上灼烧至表面变黑的Cu丝冷却后插入乙醇中,Cu丝表面仍是黑色
③要除去甲烷中混有乙烯得到干燥纯净的甲烷,将甲烷和乙烯的混合气体通过溴水
④做葡萄糖的还原性实验时,当加入新制的氢氧化铜碱性悬浊溶液后,未出现红色沉淀
⑤检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液后未析出银镜.

-
(1) A中官能团的名称是,B中官能团的电子式是.
-
(2) 反应⑥除得到G物质外,最多还可能得到种有机产物.
-
(3) 写出物质F同系物含5个碳原子的同分异构体中,一氯代物种类最少的物质的结构简式.
-
(4) 写出反应②的化学方程式.
-
(5) 用
 物质D和
物质D和  物质B进行反应④,如果实际产率是理论产率的67%,则可得到乙酸乙酯的质量是g(计算结果保留到小数点后1位,下一个空要求相同).该温度下反应的平衡常数为.
物质B进行反应④,如果实际产率是理论产率的67%,则可得到乙酸乙酯的质量是g(计算结果保留到小数点后1位,下一个空要求相同).该温度下反应的平衡常数为.
|
乙醇 |
溴乙烷 |
液溴 |
|
|
相对分子质量 |
46 |
109 |
160 |
|
状态 |
无色液体 |
无色液体 |
深红色液体 |
|
密度/(g·cm-3) |
0.79 |
1.44 |
3.1 |
|
沸点/℃ |
78.5 |
38.4 |
59 |
-
(1) I.溴乙烷的制备:
反应原理如下:
H2SO4+NaBr
 NaHSO4+HBr↑
NaHSO4+HBr↑ CH3CH2OH+HBr
 CH3CH2Br+H2O
CH3CH2Br+H2O实验装置如图(加热装置夹持装置均省略):

图甲中B仪器的名称,作用为。
-
(2) 若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应生成了;F连接导管通入稀NaOH溶液中,其目的主要是吸收等尾气防止污染空气。
-
(3) II.溴乙烷性质的探究。用如图实验装置验证溴乙烷的性质:

在乙中试管内加入10 mL 6 mol·L-1 NaOH溶液和2 mL溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为。
-
(4) 若将乙中试管里的NaOH溶液换成NaOH乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a试管中的水的作用是;若无a试管,将生成的气体直接通入b试管中,则b中的试剂可以为。



