还原反应与金属的冶炼 知识点题库
请你根据对金属和金属材料的认识,回答下列问题.

-
(1) 如图1标出的是组成灯泡的物质,所标出的物质中不属于金属材料的是 .
-
(2) 钢铁厂以赤铁矿为原料冶炼生铁的原理为 (用化学方程式表示).很多大型场馆的建设使用了大量的钢材,主要是因为钢比纯铁具有 的优良性能.
-
(3) 工人师傅切割铁板时,用硫酸铜溶液在铁板上划线可以留下红色痕迹,该变化的原理是 (用化学方程式表示).将生铁加入足量的稀盐酸中,充分反应后得到浅绿色溶液,该洛液中含有的金属离子主要是 (写符号),溶液底部残留的黑色不溶物主要是 .
-
(4) 某化学兴趣小组的同学在探究锌、铜、铁三种金属的有关性质时,进行了如图2所示实验:
①在A实验中发生反应的化学方程式为 .
②将A实验结束后①、②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤,同学们向滤渣中滴加稀盐酸,结果没有气泡产生,那么滤液中一定含有的溶质是 .
如图是课堂中模拟炼铁的实验装置.

(1)实验过程中,先要进行的是 (填Ⅰ或Ⅱ)Ⅰ.加热Ⅱ.通一氧化碳,其目的是 .
(2)A中反应的化学方程式是 .
(3)B中反应的现象是 .
(4)该装置的不足之处是 .
 实验室制取二氧化碳
B .
实验室制取二氧化碳
B .  氢气还原氧化铜
C .
氢气还原氧化铜
C .  用KMnO4制取氧气
D .
用KMnO4制取氧气
D .  往试管中加入锌粒
往试管中加入锌粒
小明同学在实验室用木炭和氧化铜两种黑色粉末在高温下反应制取单质铜,反应的化学方程式为:C+2CuO高温 2Cu+CO2↑他联想到单质碳的一些化学性质,认为在该实验中还可能会有CO产生。
查阅资料:CO气体能使湿润的黄色氯化钯试纸变蓝色。

实验验证:
-
(1) 点燃A处酒精灯,数分钟后发现 现象,说明木炭与氧化铜发生了反应,有CO2和CO气体生成,证明小明同学的判断是正确的。
-
(2) 小明同学对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
②原因二:反应C+2CuO高温 2Cu+CO2↑中的一种产物和反应物木炭又发生了新的化学反应,产生了CO;
③原因三:……
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理:。
-
(3) 在设计实验装置时还要考虑环保因素,因此要在装置C处添加装置。
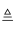 Cu+CO2的反应中,作还原剂的是( )
Cu+CO2的反应中,作还原剂的是( )
 2MgO+C.下列说法错误的是( )
2MgO+C.下列说法错误的是( )
 Al2O3+2Fe。有关该反应的说法中,正确的是( )
Al2O3+2Fe。有关该反应的说法中,正确的是( )

-
(1) 设计与实验:同学们设计了甲图装置(固定装置未画出),将天然气在氧气中点燃后得到的混合气体通过该装置进行实验。开始时应(填“先通气体”或“先加热”);加热过程中发现黑色CuO固体变红,澄清石灰水变浑浊。写出CuO固体变红的化学方程式。仅根据甲图装置出现的现象,写出混合气体所有的可能组成。
-
(2) 评价与改进:小聪认为上述实验方案有缺陷,通过讨论,增加了乙图中的3个装置(固定装置未画出),对方案作了改进并进行实验:将混合气体先通过乙图中连接的装置后,再通入甲图装置。实验中部分现象如下:A装置质量增加,B装置中溶液不变浑浊,甲图装置中实验现象与(1)相同。

请你写出改进方案的装置连接顺序(装置不重复使用):混合气体→→甲图装置(填装置编号)
交流与讨论:通过对改进实验的现象分析,同学们得出了正确的结论。
 Cu+CO2实验室现有如图所示实验装置
Cu+CO2实验室现有如图所示实验装置 
-
(1) C装置的现象为: 。
-
(2) 下列关于说法正确的是( )A . 装置A是为了检验二氧化碳 B . 装置B是为了吸收二氧化碳 C . 实验开始时应先加热再通入气体 D . 装置D将会出现白色沉淀
-
(3) CO和CO2的混合气体,通过炽热的足量氧化铜粉末,生成了6.4克红色的铜.问:参加反应的CO的质量是多少?
-
(4) 从安全环保的角度,请你对该装置进行完善: 。

-
(1) 图甲、乙实验过程中,观察到相同的实验现象是。
-
(2) 如图甲实验,加热前进行的是操作是先通入一段时间一氧化碳气体,目的是。
-
(3) 对图甲、乙实验的分析正确的是(填编号)。
a.图乙C中的试管口略向下倾斜是为了防止冷凝水倒流
b.图甲、乙实验结束时为防止液体倒流,都要先将导管移出石灰水,再熄灭酒精灯或喷灯
-
(4) 从实验安全角度考虑,图示装置还应采取的改进措施是。

注:图1中的仪器甲是一种加热仪器,图2中A、B点的固体组成分别是铁的氧化物中的一种。
-
(1) 查阅资料发现,酒精灯加热时玻璃管的受热温度是400~500℃,酒精喷灯加热时玻璃管的受热温度是800~1200℃。实验室要利用图1来制取金属铁,仪器甲应选用的加热仪器是(填“酒精灯”或“酒精喷灯”);图l装置明显存在的不足之处是。
-
(2) 利用图2显示的相关信息,回答如下问题。
①在0~400℃温度范围内,管内固体质量不变,其原因是。
②图中x=g。
实验一:验证H2和CO的还原性
-
(1) 装置的正确连接顺序是(按顺序书写字母,且每套装置限用一次);能证明H2具有还原性的实验现象是。
-
(2) 有人质疑使澄清石灰水变浑浊的不一定是CO2 , 也有可能是CO或H2;因此提出CO和H2在与氧化铜反应前应先通入澄清石灰水加以检验。小乐认为从实验操作角度分析,没有必要补充上述检验,理由是。
-
(3) 实验二:定量分析混合气体中H2和CO的质量比 小乐在实验前后对B、C装置(硬质玻璃管和内部药品)进行了质量的测定,假设B、C装置中反应完全,则H2和CO的质量比为。
装置 实验前 实验后 B 100.8g 102.6g C 65.6g 62.4g

-
(1) 写出该实验玻璃管内出现的现象是。
-
(2) 实验时,先称量出玻璃管及样品的总质量为m1 , 待反应完全后再次称量其质量为m2 , 利用m1-m2的值,求出样品中氧化铜的质量分数。其中m1-m2的值是指的质量。
-
(3) 同学们查阅到CO除了具有可燃性、难溶于水等性质外,还具有毒性。因此,本实验中需对尾气进行处理,请你提出一种处理方法。
为测定含杂质(杂质不参加反应)的氧化铜样品中氧化铜的质量分数。小柯同学取了10克氧化铜样品利用下图所示装置进行了实验,并分别称量了部分装置反应前后的质量情况,得到下表中的两组数据:

| 反应前 | 完全反应后 | |
| A组 | 玻璃管和固体物质的质量共42.5克 | 玻璃管和固体物质的质量共40.9克 |
| B组 | U形管和其中物质的质量共180.0克 | U形管和其中物质的质量共182.3克 |
请回答下列问题:
-
(1) 小柯分析后决定用A组数据进行计算,且得出A组中玻璃管和固体物质反应前后减少的质量是元素的质量,并计算得出样品中氧化铜的质量为;
-
(2) 小柯不选择“B组”实验数据来计算样品中的氧化铜的质量分数,原因是;
-
(3) 若要使两组数据计算得到的结果一样,应将图中装有(写试剂名称)的E装置连接在图中A和B装置之间。
【猜想与假设】木炭与Na2O2反应可能生成4种物质:CO、CO2、Na2O和Na2CO3。
【查阅资料】①氧化钠(Na2O)是白色固体,与H2O反应生成NaOH。
②氯化钯(PdCl2)溶液能检验CO的存在,向溶液中通入CO,产生黑色沉淀。
【进行实验】同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去)。

实验记录如表:
| 序号 | 实验操作 | 主要实验现象 |
| ① | 检查装置气密性。向玻璃管中加入过氧化钠和过量木炭粉的混合物。打开弹簧夹a、b,关闭c,从装置左端通一段时间N2 | A中无明显变化,B中有大量气泡冒出 |
| ② | 关闭a,点燃酒精灯 | 试管中发生剧烈反应,产生火花,B中石灰水无明显现象 |
| ③ | 打开c,关闭b | C中PdCl2溶液没有明显变化 |
| ④ | 打开a,继续通N2 , 停止加热,待冷却后停止通N2。取出少量反应后固体于试管中,加入足量稀盐酸,迅速用带导管的橡胶塞塞紧试管口,导管另一端通入石灰水中 | 有气泡生成,石灰水变浑浊 |
【解释与结论】
-
(1) 步骤④中若不通入氮气,可能造成的结果是。
-
(2) 检验第 4 种物质存在的实验方案及现象:取出少量反应后固体于试管中,加入足量水充分溶解,再加入足量的,过滤,向滤液中滴加几滴无色酚酞试液,溶液变红。
-
(3) Na2O2 与木炭反应的化学方程式为 。

-
(1) 从实验的的现象中我们可以推导出氢气的化学性质有 。
-
(2) 实验结束时烧黑的铜片右边部分变成红色,左边还是黑色,请你写出左边还是黑色的原因。
-
(3) 能否用铜片代替镁条进行实验,请说明的原因。



