金属活动性顺序及其应用 知识点
应用:(1)判断金属能否与酸反应,金属活动性顺序中排在氢前的金属能与稀盐酸、稀硫酸发生反应生成盐和氢气
(2)判断金属能否与盐溶液反应,排在前面的金属能与排在后面的金属的盐溶液发生反应(钾、钠、钙除外)
金属活动性顺序及其应用 知识点题库
-
(1) 据有关报道,每年因锈蚀而报废的铁制品约占年产量的20%~40%,铁制品生锈的条件是.
-
(2) 写出用稀盐酸除铁锈的化学方程式.
-
(3) 同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序.实验室提供的药品有:
Cu(NO3)2溶液、AgNO3溶液、Fe(NO3)2溶液、稀盐酸、铜丝、铁丝、银丝.
Ⅰ、小华同学设计并完成了如下实验:
①把铁丝插入装有稀盐酸的试管中; ②把铜丝插入装有稀盐酸的试管中;
③把银丝插入装有稀盐酸的试管中; ④把铜丝插入装有AgNO3溶液的试管中.
观察到①中的实验现象是,④中的化学方程式是.你认为小华所做的实验(填序号)是多余的.
Ⅱ、后来,小贝只选用了上述药品中的三种,通过两步实验,也达到了实验目的.他选用的三种药品是(写出一种药品组合即可).
-
(1) 铝能制成铝箔是因为铝具有良好的性;
-
(2) 在金属活动性顺序中,铁、铜、铝、锌由强到弱排列的顺序是(填元素符号)
-
(3) 任写出一个稀盐酸能与上述金属能发生反应的化学方程式
A.R>Cu B.R>H C. R>Zn D.R>
-
(1) 铜常用于制作导线,因为其具有良好的。
-
(2) 将纯铝和铝合金相互刻划。纯铝上留有明显的痕迹,说明。
-
(3) 如下图,向一定量的硝酸银溶液中加入铜和锌的混合粉末,充分反应后过滤,得到溶液甲和固体乙。

① 以下说法正确的是(多选)
A.溶液甲中一定含有硝酸铜
B.溶液甲中一定含有硝酸锌
C.固体乙一定会有银析出
D.在溶液甲中滴加盐酸,若生成白色沉淀,则在固体乙中加入稀盐酸一定没有氢气产生。
②若乙中含有铜、锌、银三种固体,则溶液甲中含有的金属离子是(填离子符号),此时取固体乙加入稀硫酸,发生反应的化学方程式为,该反应类型为反应。
-
(1) 厨房中的下列物品所使用的主要材料属于金属材料的是。
a.陶瓷碗 b.不锈钢炊具 c.橡胶手套 d.塑料盆
-
(2) 铝块能制成铝箔是利用了铝的性(填“导电”或“延展”)。空气中,铝比铁具有更好的抗腐蚀性,原因是(用化学方程式表示)。
-
(3) 已知金属M和N能够发生如下反应:Fe+MCl2=M+FeCl2 , N+FeCl2=Fe+NCl2,判断Fe、M、N三种金属的活动性有强到弱的顺序是。
-
(4) 为探究铝、铜的金属活动性顺序,某同学选用了下列药品进行实验,其中可行的是(填字母)。
a.铝丝、铜丝、氯化镁溶液 b.铝丝、铜丝、硫酸铜溶液
-
(5) 铁制容器不能用来盛放农药波尔多液(主要成分是硫酸铜和氢氧化钙),用化学方程式表示其原因:,该反应属于反应。
-
(6) 防止金属腐蚀是保护金属资源的有效途径之一,写出一种防止铁制品生锈的具体方法:。
①一定有锌 ②一定有铁 ③一定有铜 ④可能有锌 ⑤可能有铁 ⑥可能有铜.
 向一定量的饱和氯化钠溶液中加入硝酸钾固体
B .
向一定量的饱和氯化钠溶液中加入硝酸钾固体
B . 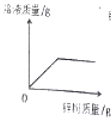 向一定量的硫酸铜溶液中不断加入锌粉
C .
向一定量的硫酸铜溶液中不断加入锌粉
C .  向铁、铜的混合粉末中加入稀盐酸
D .
向铁、铜的混合粉末中加入稀盐酸
D .  向两份完全相同的稀盐酸中加入金属
向两份完全相同的稀盐酸中加入金属

-
(1) 金属板中加稀硫酸前通常要先进行粉碎处理,这样操作的目的是。
-
(2) 操作①中玻璃棒的作用是。
-
(3) 滤液①种含有的阳离子有种;请写出在滤液①中加过量铁粉发生的一个反应的化学方程式。
-
(4) 滤渣①中加稀硫酸并通氯气发生的反应为:
 ,其中X的化学式为。
,其中X的化学式为。
-
(5) 铁和镍的金属活动性顺序是。
-
(1) Tl2O3读作
-
(2) 在加热条件下,氧化亚铊(Tl2O)与氢气反应生成铊和水,该反应的化学方程式为:
-
(3) 取少量无色硫酸亚铊溶液于试管中,再滴加适量氢氧化钡溶液,充分振荡,静置,观察到的实验现象是
-
(4) 已知Fe、Tl、Cu的金属活动性由强至弱的顺序为:Fe>Tl>(H)>Cu,以下说法正确的是______A . 将金属Tl伸入稀硫酸中,金属表面有气泡冒出 B . 将铜丝伸入Tl2SO4溶液中,铜丝表面附着一层固体 C . 把锌伸入TlCl溶液中,可发生如下反应:Zn+2TlCl=2Tl+ ZnCl2
-
(1) 考古工作者发现出土的铁质文物往往锈蚀严重,铁生锈的条件是。
-
(2) 铝合金被广泛应用于制造飞机、高铁等,这是因为铝合金具有硬度(填“大”或“小”)、质量轻、耐腐蚀等特性。
-
(3) 某合金中含有金属钪(Sc)。相同条件下,取等质量的钪粉和锌粉分别与等质量、等浓度的盐酸反应,钪产生气泡速率明显更快,则金属活动性: SeZn (填“>”或“<”)。
-
(4) 根据以上规律,将Sc投入CuSO4溶液中,可观察到。若要验证钪和铁的活动性强弱,需要用到粉和溶液。
①“王水”溶解黄金是化学变化;②金比氢活泼;③HAuCl4中,Au的化合价为+3价;④“王水”可以用铁质容器盛装。
-
(1) 老师的金项链放入稀硫酸中看不到任何现象,小明把自己带来的“黄金戒指”放入稀硫酸中后发现有气泡产生。
①请你写出产生气泡的化学方程式。
②如果把小明的“黄金戒指”放入AgNO3溶液中片刻后拿出来,现象是。
-
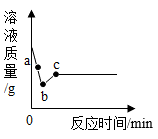
(2) 某化学小组向一定量的Mg(NO3)2、AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,然后过滤,并对滤液和滤渣的成分进行了分析和实验探究。
①向滤渣上滴加稀盐酸,有气泡产生,则滤液中的溶质是。
②反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变,为什么?
-
(3) 下图装置可做CO还原Fe2O3的实验,并检验该反应生成的气体产物,其中A装置的作用是将二氧化碳和炭粉在高温下转化为一氧化碳, D装置可以吸收二氧化碳。

①实验室中制取二氧化碳的化学方程式。
②B装置玻璃管里发生反应的化学方程式为。
③要达到实验目的,装置从左到右的连接顺序为(装置不能重复使用)。
-
(4) 工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?

-
(1) 石英砂的主要物质由硅元素和氧元素组成,其中硅元素(Si)的化合价为+4价。写出该物质的化学式。
-
(2) 溶洞中形态各异的钟乳石的形成过程可以简单的理解为石灰岩长时间缓慢地“溶解”在水中,“水”在滴落时又缓慢的生长出钟乳。主要反应的化学方程式为:
Ⅰ、CaCO3+CO2+H2O=Ca(HCO3)2;
Ⅱ、Ca(HCO3)2=CaCO3↓+CO2↑+H2O
属于分解反应的是(选填“Ⅰ”或“Ⅱ”)。
-
(3) 黄铜是铸造贺龙元帅铜像的主要材料。在放有黄铜的试管中加入稀硫酸,有气泡产生,且该气体能燃烧,则黄铜中可能含有的金属是(选填“锌”或“银”);黄铜比纯铜具有塑性好、熔点低、(写一条性质)等优良性能。选用锌、铜、硫酸铜溶液和硝酸银溶液能验证锌、铜、银三种金属活动性强弱;若不选用硫酸铜溶液,此验证实验仍能进行,试说明理由。
![]()
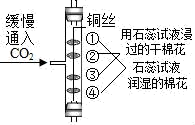 证明CO2密度比空气大且能与水反应产生酸
B .
证明CO2密度比空气大且能与水反应产生酸
B .  测定空气中氧气的含量
C .
测定空气中氧气的含量
C . 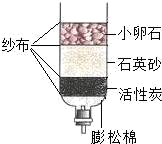 将河水转化为纯净水
D .
将河水转化为纯净水
D .  验证Cu和Ag的金属活动性大小
验证Cu和Ag的金属活动性大小
下列说法错误的是( )



