晶体和结晶的概念与现象 知识点
结晶是指固体溶质从(过)饱和溶液中析出的过程。从溶液中析出的溶质大致可分为晶形沉淀和无定形沉淀。
晶体是有明确衍射图案的固体,其原子或分子在空间按一定规律周期重复地排列。晶体中原子或分子的排列具有三维空间的周期性,隔一定的距离重复出现,这种周期性规律是晶体结构中最基本的特征。
注意事项:
结晶是分离可溶性固体与水的一种混合物分离方法。
结晶方法分蒸发结晶,降温结晶。
晶体和结晶的概念与现象 知识点题库

-
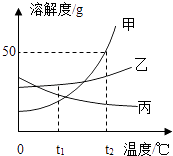
(1) 温度越高,溶解度越小的物质是(填写代号);
-
(2) 现有A,B,C三种物质的浓溶液,适用海水晒盐原理进行结晶提纯的是(填写代号);
-
(3) 当溶液的浓度都用溶质的质量分数(m)表示时,下列说法中不正确的是.
①t1℃时,A,C两种物质的溶解度相等,两种溶液的浓度也相等
②t1℃时,A,B,C三种溶液的浓度可能相等
③将t2℃的A,B,C三种饱和溶液的温度分别降至t1℃时,A溶液中析出的晶体最多
④将t2℃的A,B,C三种饱和溶液的温度分别降至t1℃时,所得溶液浓度的大小顺序为m(B)>m(A)=m(C)
⑤将t1℃的A,B,C三种溶液分别升温,其浓度都不可能发生变化
⑥将t2℃的A,B,C三种溶液分别降温,其浓度都可能发生变化.

-
(1) 请解释这种现象发生的主要原因是什么?
-
(2) 若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数与原饱和硝酸钾溶液的溶质质量分数是否相等?

-
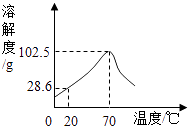
(1) t1℃时,三种物质中溶解度最大的是.
-
(2) 溶解度随温度升高而减小的是.
-
(3) t2℃,将质量相等的甲、乙、丙三种物质的饱和溶液降温至t3℃,析出晶体最多的是.
-
(4) t2℃,将30g甲物质加入到50g水中充分搅拌,形成甲物质的(填“饱和溶液”或“不饱和溶液”)

-
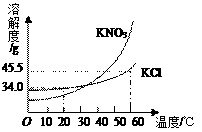
(1) NaCl溶液能够导电,NaCl在水中能够解离出的阳离子是(用化学用语表示)
-
(2) 90℃时,MgCl₂的溶解度是,在该温度下配制MgCl₂溶液,溶质质量分数最大为(只列算式,不需要计算结果)。
-
(3) 90℃时,向100g水中加入40gKCl,所得的溶液为溶液(填“饱和”或“不饱和”);将上述溶液蒸发掉50g水后恢复到90℃,析出固体的质量是g。
-
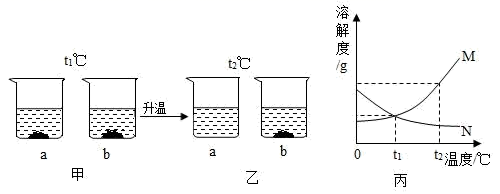
(4) 如乙图所示,60℃时把试管放入盛有MgSO4的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,此时观察到的现象有:试管中的镁条和盐酸剧烈反应,产生大量气泡,并立即放出大量的热,同时还观察到烧杯中。


-
(1) 试剂 A 的名称为。
-
(2) 试剂 B 的化学式是,若加入的试剂A、B都是过量的,则加入试剂 B 发生的非中和反应的化学反应方程式是。操作Ⅰ的名称是,该操作中除用到玻璃仪器外,还需要的实验用品有。
-
(3) 酸化过程加试剂 A 的作用。
-
(4) “操作Ⅱ”包含的操作有:蒸发浓缩、、过滤、洗涤、干燥等。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | Na2CO3 | 7 | 12.2 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
-
(1) 表中三种物质中,溶解性属于可溶的物质是。
-
(2) 在50℃时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为 ;保持烧杯中各物质质量不变,降温至40℃时,所得溶液溶质的质量分数会(填“变小”、“不变”或“变大”)。
-
(3) 请根据表格中数据,在下图中绘制出碳酸钠的溶解度曲线。

-
(4) 根据溶解度曲线回答下列问题:
①60℃时,向等质量的上述四种固体物质中分别加水配成饱和溶液,所得溶液质量由大到小的顺序是。
②侯氏制碱法的关键步骤是:先向饱和食盐水中通入氨气,制成饱和氨盐水,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,其化学方程式为NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3。请问生成的碳酸氢钠和氯化铵,哪种物质首先析出,理由是。
-
(1) 打开汽水瓶盖时,汽水会自动喷出来,说明气体在水中的溶解度随而减小。
-
(2) 水是一种重要的溶剂,欲配制50g溶质质量分数为10%的氯化钠溶液(水的密度是1.0g/cm3),请回答下列问题:
①称量氯化钠固体的质量为g;
②下列仪器中必须使用的是(填序号)。
A.托盘天平
B.烧杯
C.玻璃棒
D.10mL量筒 E.50mL量筒
-
(3) 甲、乙两种固体物质(不含结晶水,且不与水反应)的溶解度曲线如图1所示。

①甲、乙两种物质中溶解度受温度影响较大的是物质。
②若将t2℃时甲的不饱和溶液变成该温度下的饱和溶液,可采用的方法。(填一种即可)
③若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是。
④t1℃时,若将25g乙固体加入50g水中,充分搅拌后,仍有9.2g乙固体未溶解,则t1℃时乙的溶解度为。
⑤t2℃接近饱和的甲溶液逐渐冷却至t1℃,图2中有关量随时间变化的趋势正确的是。(选序号)

-
(1) 大量甲中含有少量乙,要提纯甲,可采用的方法是。
-
(2) 40℃时,分别将等质量的甲、乙配制成饱和溶液,所得溶液的质量关系为:甲乙(填“>”“<”或“=”)。
-
(3) 20℃时,将65g甲的饱和溶液加水稀释成10%,需要加入水的质量为g。
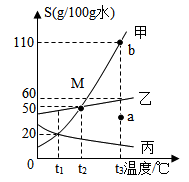
①t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是.
②t2℃时,将30g乙物质放入50g水中,充分搅拌,所得溶液的质量是.
③当甲物质中混有少量乙物质时,提纯甲的方法是.
④若要将a点的甲溶液转化为b点的甲溶液,采用的方法有或.
⑤若将t2℃三种物质的饱和溶液分别降温到t1℃时,则三种溶液中溶质的质量分数由大到小的顺序是.
⑥t2℃时,将含有100克水的甲和乙的饱和溶液,分别加入m克甲和m克乙,升温至t3℃,甲完全溶解,乙仍有剩余,则m的质量范围是.

-
(1) 20℃时,饱和溶液的溶质质量分数相等的物质是。
-
(2) 不改变溶液的成分,将丙的不饱和溶液变为饱和溶液的方法是。
-
(3) 20℃时,把60 g甲物质加入50g水中,得到溶液的质量为g,若要得到溶质质量分数为50%的甲溶液,继续进行的具体操作是。
-
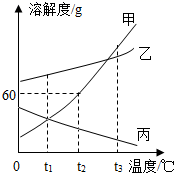
(1) 丙物质的溶解度随温度的升高而。(填“增大”或“减小”)。
-
(2) t1℃时,将甲物质的饱和溶液升温到t3℃,所得溶液中溶质的质量分数。(填“变大”、“变小”或“不变”)。
-
(3) t2℃时,将100g水加入到盛有30g甲物质的烧杯中,充分溶解后得到不饱和溶液,若想使溶液恰好饱和,可采用的方法是:。
-
(4) t3℃时,甲、乙、丙三种物质的溶解度的由大到小的顺序是。




