催化剂的特点与催化作用 知识点题库
-
(1) 二氧化锰在反应中的作用是.
-
(2)
下列仪器中:①的名称是;组装O2发生装置时,应选择(填序号).

-
(3) 研究显示:O2的体积分数大于36%时就可使带火星的木条复燃.因此,O2验满时采用使带火星的木条复燃的方法(填“可靠”或“不可靠”).为了收集一瓶较纯净的O2 , 最好采用集气法.
①同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气.为了验证加热双氧水也可以制取氧气,同学们可以选择下列图1中的(选填编号)装置(气密性良好)进行实验.实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是,因此加热不适合用于双氧水制取氧气.
②同学们还想探究双氧水的溶质质量分数对反应速率的影响.在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间.
实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 40 | 5 | 200 |
2 | 20 | 30 | 5 | 100 |
3 | 30 | 20 | 67 |
Ⅰ.取用二氧化锰的仪器是图2中的(选填编号).
Ⅱ.写出上述反应的化学反应方程式.
Ⅲ.本实验中收集氧气选用的装置有(选填编号).
Ⅳ.实验2中双氧水溶质质量分数为.
Ⅴ.实验3中,加入的二氧化锰质量为 g.
Ⅵ.相同条件下,实验3产生氧气的速率最快,说明.

 探究的是分子之间是否有间隔的
B .
探究的是分子之间是否有间隔的
B .  探究的是金属的锈蚀是否需要水
C .
探究的是金属的锈蚀是否需要水
C .  探究的是MnO2对H2O2分解的催化作用
D .
探究的是MnO2对H2O2分解的催化作用
D .  探究的是可燃物燃烧是否需要与氧气充分接触
探究的是可燃物燃烧是否需要与氧气充分接触
实验一:图中的实验能否证明MnO2是双氧水分解反应的催化剂?并说明理由.
数据记录表
1%H2O2溶液(mL) | 50 | 50 | 50 |
加入MnO2的质量(g) | 0.1 | 0.2 | 0.4 |
测量40秒末得到O2体积(mL) |
实验二:从从表格的设计可以看出,该实验的目的是.

 B . 双氧水制氧气时二氧化锰的质量与反应时间的关系
B . 双氧水制氧气时二氧化锰的质量与反应时间的关系 C . 加热高锰酸钾制氧气时氧气质量与加热时间的关系
C . 加热高锰酸钾制氧气时氧气质量与加热时间的关系 D . 石灰石与稀盐酸反应制二氧化碳时二氧化碳质量与反应时间的关系
D . 石灰石与稀盐酸反应制二氧化碳时二氧化碳质量与反应时间的关系
 加热一定量的高锰酸钾固体
B .
加热一定量的高锰酸钾固体
B .  向一定量的二氧化锰中加入过氧化氢溶液
C .
向一定量的二氧化锰中加入过氧化氢溶液
C .  用等质量氯酸钾制取氧气
D .
用等质量氯酸钾制取氧气
D .  将水通电电解一段时间
将水通电电解一段时间
|
|
| |
A.向一定量的二氧化锰中加入过氧化氢溶液 | B.加热一定量高锰酸钾制取氧气 | C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉。 | D.用木炭还原氧化铜 |
A.  加热等质量的氯酸钾
加热等质量的氯酸钾
B.  通电分解水
通电分解水
C.  向一定量的氢氧化钠溶液中逐渐加入稀盐酸
向一定量的氢氧化钠溶液中逐渐加入稀盐酸
D.  将一定量含有盐酸的氯化钙溶液中逐渐加入碳酸钾溶液,则图中物质R是。
将一定量含有盐酸的氯化钙溶液中逐渐加入碳酸钾溶液,则图中物质R是。
-
(1) 实验过程
①在试管中加入5 mL “双氧水”,把带火星的木条伸入试管中,发现木条未复燃,原因是:。
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃,原因是:。
③如图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 。

-
(2) 实验结论:
-
(3) 依据所做的实验,影响化学反应速率的因素可能有等。

-
(1) 甲锥形瓶内发生的反应化学方程式为;
-
(2) 由图Ⅰ分析可知:曲线(填“①”或“②”)表示无二氧化锰条件下发生的反应;
-
(3) 用图Ⅱ装置收集O2 , 验满时应将带火星的木条放在(填“x”或“y”)导管口处。

-
(4) 图Ⅲ为电解水制氧气的装置图,气体b在电源的(填“正”或“负”)极端产生,如果该实验中产生氧气0.2mol,则发生分解的水的质量为几克?(请根据化学方程式列式计算)
-
(5) 图Ⅳ为测定空气中氧气含量的实验,该装置中发生化学反应的化学方程式为,在瓶内加少量水并将水面上方空间分为5等份,接下来的实验步骤依次为(填序号),最后打开弹簧夹。
a、冷却到室温
b、弹簧夹夹紧橡皮管
c、点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧


-
(1) 写出该反应的符号表达式为。
-
(2) 对该反应的历程,下列分析正确的是。
A 催化剂将不断减少 B 原子结构发生了改变
C 分子发生了变化 D 乙酸属氧化物
 相同质量的镁和锌分别与足量等浓度的稀硫酸反应
B .
相同质量的镁和锌分别与足量等浓度的稀硫酸反应
B .  电解水生成气体的体积
C .
电解水生成气体的体积
C .  加热氯酸钾和加热等质量的氯酸钾与少量二氧化锰混合物,产生氧气质量
D .
加热氯酸钾和加热等质量的氯酸钾与少量二氧化锰混合物,产生氧气质量
D .  空气中氧气含量的测定装置,广口瓶内气体体积变化
空气中氧气含量的测定装置,广口瓶内气体体积变化
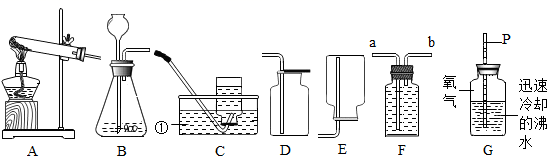
已知:二氧化碳与氢氧化钠溶液反应生成可溶于水的碳酸钠
-
(1) 写出仪器①的名称: 。
-
(2) 从A~E仪器装置中,选择制取二氧化碳的发生和收集装置。 写出该反应的符号表达式为。小张用H所示矿泉水瓶收集一瓶二氧化碳,倒入澄清石灰水,旋紧瓶塞后充分振荡,看到现象为澄清石灰水变浑浊,矿泉水瓶变瘪,从而证明CO2与澄清石灰水确实发生了反应,请写出石灰水变浑浊的符号表达式。小李用氢氧化钠溶液代替石灰水进行该实验,看到矿泉水瓶变瘪,认为也能证明二氧化碳能与氢氧化钠溶液反应,理由是,小王认为不合理,理由是,他认为还要补充一个实验,请你写出实验方案。
-
(3) 按下表进行制取二氧化碳实验,取等质量的大理石加入足量的酸中(设杂质不与酸反应),产生的二氧化碳体积随时间的变化曲线如图1所示:

实验编号
药品
I
块状大理石、10%稀硫酸溶液
Ⅱ
块状大理石、7%稀盐酸溶液
Ⅲ
粉末状大理石、7%稀盐酸溶液
实验Ⅱ对应的曲线是。对比实验Ⅱ和实验Ⅲ,说明,化学反应的速率越快。
-
(4) 实验室用一种紫黑色固体和装置A、F制取O2该反应的符号表达式为,盛满水的F装置收集氧气时,应从导管 (填“a”或“b”处通入)。
-
(5) 向盛有氧气的集气瓶中倒入迅速冷却后的沸水,立即塞紧穿有两端开口细玻璃管的橡皮塞,用注射器向玻璃管中注水至P处,装置如图G所示:
①手拿集气瓶在水平面上摇晃数十次后,看到玻璃管中的液面将(选填“上升”、“下降”或“不变”);已知:其他条件相同时,温度越高,气体在水中溶解性越差。
②下列有关该实验的说法正确的是。
a可说明有少量氧气溶于水中
b应保证装置有良好的气密性
c用迅速冷却的沸水是因为其中几乎不含氧气
-
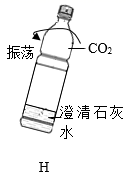
(6) 某化学兴趣小组设计如下表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图2所示。

实验序号
过氧化氢溶液
催化剂
实验1
5mL 4%
粉末状MnO2 0.2g
实验2
5mL 4%
粉末状CuO 0.2g
①实验2中制取氧气的符号表达式为。
②实验需要测量并记录的数据有:氧气体积和。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右侧液面上升,原因是。
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是。
物质 | a | b | c | d |
反应前的质量/g | 40 | 5 | 16 | 15 |
反应后的质量/g | X | 5 | 30 | 26 |







