溶质的质量分数及相关计算 知识点题库
甲、乙两种物质的溶解度曲线如图所示.下列说法中正确的是( )

A . t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液
B . t2℃时,甲、乙饱和溶液的溶质质量分数都为30%
C . t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和
D . t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙
向10g CaCO3中不断加入稀盐酸,其质量变化如图所示,请回答下列问题:

-
(1) 当10gCaCO3恰好完全反应时,所加稀盐酸的质量为.
-
(2) 所加稀盐酸的溶质质量分数为多少?(写出计算过程,结果精确到0.01%)
将15g镁、铁、锌混合物放入200g稀硫酸中恰好完全反应,然后对所得混合溶液在无氧条件下进行蒸发,得到63g不含结晶水的固体.则所用稀硫酸的溶质质量分数为( )
A . 4.9%
B . 9.8%
C . 19.6%
D . 24.5%
取10锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据.
第1次 | 第2次 | 第3次 | 第4次 | |
加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |
-
(1) 混合物中铜粉的质量分数是多少?
-
(2) 计算所用稀硫酸中溶质的质量分数.(保留计算过程)
根据如图溶解度曲线,判断下列说法正确的是( )

A . t1℃时,在甲的饱和溶液中加入甲,溶液的质量增大
B . t2℃时,甲、乙两溶液的质量分数一定相等
C . t3℃时,将等质量的甲、乙的饱和溶液都蒸发掉10g水,甲析出的晶体质量大
D . 把t1℃时甲、乙的饱和溶液升温至t3℃时,两溶液的质量分数都会增大
向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示,求

-
(1) 镁粉的质量;
-
(2) NaOH溶液的溶质质量分数.
为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取混合物10g,放入一干净的烧杯中,然后取一定溶质质量分数的稀硫酸100g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.12 | x | 0.36 | 0.4 | y |
-
(1) 上表中x=、y=.
-
(2) 固体混合物中镁元素的质量分数为.
-
(3) 所用稀硫酸的溶质质量分数为多少?
请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:

-
(1) 实验所用稀盐酸的溶质的质量分数为.
-
(2) 所得溶液中溶质的质量分数为多少?(写出计算过程).
将91.6g氢氧化钾溶液与一定质量的氯化镁溶液混合,恰好完全反应,过滤后,得到11.6g沉淀和280g滤液,求氯化镁溶液的溶质质量分数.
下列四个图象与对应叙述不符合的是( )
A .  向100g10%的氢氧化钠溶液中逐滴加入100g10%稀盐酸
B .
向100g10%的氢氧化钠溶液中逐滴加入100g10%稀盐酸
B .  向盛有部分变质的NaOH的溶液的烧杯中滴加稀硫酸至过量
C .
向盛有部分变质的NaOH的溶液的烧杯中滴加稀硫酸至过量
C .  将t2℃时溶质质量分数都为10%的a、b、c三种物质的溶液降温到t1℃所得溶液的溶质质量分数还都是10%
D .
将t2℃时溶质质量分数都为10%的a、b、c三种物质的溶液降温到t1℃所得溶液的溶质质量分数还都是10%
D .  向一定量NaOH和BaCl2的混合溶液中滴加稀硫酸至过量
向一定量NaOH和BaCl2的混合溶液中滴加稀硫酸至过量
 向100g10%的氢氧化钠溶液中逐滴加入100g10%稀盐酸
B .
向100g10%的氢氧化钠溶液中逐滴加入100g10%稀盐酸
B .  向盛有部分变质的NaOH的溶液的烧杯中滴加稀硫酸至过量
C .
向盛有部分变质的NaOH的溶液的烧杯中滴加稀硫酸至过量
C .  将t2℃时溶质质量分数都为10%的a、b、c三种物质的溶液降温到t1℃所得溶液的溶质质量分数还都是10%
D .
将t2℃时溶质质量分数都为10%的a、b、c三种物质的溶液降温到t1℃所得溶液的溶质质量分数还都是10%
D .  向一定量NaOH和BaCl2的混合溶液中滴加稀硫酸至过量
向一定量NaOH和BaCl2的混合溶液中滴加稀硫酸至过量
下图是甲、乙、丙三种固体物质的溶解度曲线,且它们溶于水时溶液温度均无明显变化。

-
(1) t3℃时,N点的丙溶液为溶液(饱和或不饱和)
-
(2) t2℃时,等质量的甲、乙两种物质的饱和溶液中溶剂的质量大小关系为甲乙(填“>”、“<”或“=”)。
-
(3) t3℃时,若要将N点的甲溶液转变为M点的甲溶液,可以采用的方法是;。
-
(4) t3℃时,M点对应的溶解度为50g,此点甲溶液的质量分数是 (保留一位小数)。
现有溶质质量分数为20%的NaOH溶液20g,与-定质量的稀盐酸恰好完全反应。
计算:
-
(1) NaOH溶液中溶质的质量为多少g
-
(2) 生成NaCl的质量多少。
根据如图A、B、C三种固体的溶解度曲线回答:

-
(1) 写出图中P点的意义。
-
(2) 要使t1℃的C的接近饱和的溶液变为饱和溶液,可采用的方法是。
①升高温度 ②降低温度 ③加入C ④蒸发水
-
(3) t2℃时,将溶液质量相等的A、B、C的饱和溶液分别蒸发10g水,所得溶液的质量从大到小的关系是。
-
(4) 将溶液质量为300g的A的饱和溶液由t2℃降温到t1℃,析出的晶体的质量为。
现有30℃时的氯化钾饱和溶液,在下列情况下溶液中溶质的质量分数不变的是()
A . 温度不变,向溶液中加入氯化钾晶体
B . 温度不变,向溶液中加入水
C . 降低温度至10℃
D . 升高温度蒸发掉一部分水,温度保持在40℃
如图是甲、乙两种固体物质的溶解度曲线,请回答:

-
(1) 在时,甲、乙两种物质的溶解度相同。
-
(2) 将t1℃甲的饱和溶液变为不饱和溶液可采用方法是。
-
(3) t2℃时,将25g甲放入装有100g水中,所得溶液质量为 。
-
(4) 下列有关说法正确是(填序号)。
①甲中含有少量的乙可采用降温结晶的方法提纯甲
②t2℃时,甲溶液的溶质质量分数比乙溶液溶质质量分数大
③t2℃时,将等质量甲、乙分别加水配成饱和溶液,所得甲溶液质量比乙溶液小
④将t2℃时甲、乙饱和溶液降温至t1℃时,所得甲、乙溶液的溶质质量分数相等
在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:

-
(1) 100g稀盐酸中氯化氢的质量。
-
(2) 完全反应后,计算生成二氧化碳的质量?(写出计算步骤)
-
(3) 完全反应后,所得溶液中溶质的质量分数?(写出计算步骤)
生活中处处有化学,根据下列信息回答问题:


-
(1) 洗涤剂除油污是利用洗涤剂的作用
-
(2) 喝了汽水会打嗝,说明气体物质的溶解度
-
(3) 铝制品抗腐蚀的原因(用化学方程式表示)
-
(4) 医用酒精中乙醇的为
-
(5) 海水晒盐的大致过程如下图,其中A处池。此时池中溶液是氯化钠的(“饱和”或“不饱和”)溶液

溶液对于自然界中的生命活动和人类生产活动具有重要意义,下图是甲、乙、丙三种固体物质的溶解度曲线(固体均不含结晶水),下列说法错误的是( )

A . 甲中混有少量乙,可采用降温结晶的方法提纯甲
B . t1℃时,将20g甲加入50g水中充分溶解后可得到70g溶液
C . t1℃时,等质量的甲和乙固体形成饱和溶液时所需水的质量关系:甲>乙
D . 将t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系:乙>甲=丙
实验室用60 g 3%H2O2水溶液制取氧气,平均分三次加入,每次加入时,发生装置内的反应液已完全反应,说法正确的是( )
A . 三次制取氧气的量一样
B . 三次反应的剧烈程度一样
C . 第三次加入后,溶质质量分数最大为1.02%
D . 第三次加入后,溶质质量分数最大为1%
海水“制碱”可采用浓海水化盐(NaCl)为原料,制取纯碱。其反应原理及部分物质的溶解度曲线如图:

①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl ②2NaHCO3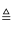 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
-
(1) 30℃时,NaHCO3、NH4Cl、NaCl三种物质的溶解度最大的是;60℃后,NaHCO3的溶解度“消失”了,原因是。
-
(2) 60℃时,氯化铵饱和溶液的质量分数为35.6%,则图中m=。
-
(3) 若向反应①滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl单独结晶析出,根据溶解度曲线分析(0℃~60℃范围),上述操作宜在(选填“低温”或“高温”)下进行。
-
(4) 农业生产中NH4Cl可用作(填“钾肥”、“氮肥”或“复合肥”)。
最近更新



