离子共存 知识点题库
在下列溶液中,各组离子可能大量共存的是
A . PH>7的溶液中:Na+、Cl-、Ba2、Fe3+
B . 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
C . 碳酸氢钠溶液中:K+、ClO-、Cl-、OH-
D . 由水电离的c(H+)=10-13 mol·L-1的溶液中:Al3+、K+、NO3-、SO42-
下列各组离子中,能在水溶液中大量共存的是( )
A . Na+、Ca2+、OH﹣、HCO  B . Ca2+、Al3+、NO3﹣、OH﹣
C . H+、Mg2+、SO42﹣、HCO
B . Ca2+、Al3+、NO3﹣、OH﹣
C . H+、Mg2+、SO42﹣、HCO  D . Fe2+、Al3+、SO42﹣、Cl﹣
D . Fe2+、Al3+、SO42﹣、Cl﹣
 B . Ca2+、Al3+、NO3﹣、OH﹣
C . H+、Mg2+、SO42﹣、HCO
B . Ca2+、Al3+、NO3﹣、OH﹣
C . H+、Mg2+、SO42﹣、HCO  D . Fe2+、Al3+、SO42﹣、Cl﹣
D . Fe2+、Al3+、SO42﹣、Cl﹣
硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A . Na+、Fe3+、K+、ClO﹣ 都可在该物质的溶液中大量共存
B . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
C . 向0.1mol•L﹣1该物质的溶液中逐滴滴加0.1mol•L﹣1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示 D . 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+2Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
D . 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+2Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
 D . 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+2Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
D . 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+2Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
下列各组离子,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A . K+ MnO4﹣ Cl﹣ SO42﹣
B . Na+ Ba2+ NO3﹣ Cl﹣
C . Na+ SO42﹣ Cu2+ Cl﹣
D . Na+ H+ NO3﹣ SO42﹣
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
-
(1) FeCl3 净水的原理是(用简练的文字叙述);FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)
-
(2) 在由水电离产生的c(H+)=1×10﹣14mol/L的溶液中,一定可以大量共存的离子组是 (填字母代号).A . NH4+、Al3+、Br﹣、SO42﹣ B . Na+、Cl﹣、Fe2+、NO3﹣ C . K+、Ba2+、Cl﹣、NO3﹣ D . K+、Na+、HCO3﹣、SO42﹣ .
常温下,下列各组离子在指定溶液中,一定可以大量共存的是( )
A . 无色溶液中 Mg2+、Al3+、SO42﹣、CO32﹣
B . pH=1的溶液中 NH4+、Ba2+、HCO3﹣、NO3﹣
C . 含MnO4﹣的溶液中 H+、K+、Br﹣、I﹣
D . 在  =1×10﹣12的溶液中 Na+、K+、CH3COO﹣、SO42﹣
=1×10﹣12的溶液中 Na+、K+、CH3COO﹣、SO42﹣
 =1×10﹣12的溶液中 Na+、K+、CH3COO﹣、SO42﹣
=1×10﹣12的溶液中 Na+、K+、CH3COO﹣、SO42﹣
下列各组离子在溶液中可以大量共存的是( )
A . I﹣、H+、Cl﹣、NO3﹣
B . Al3+、K+、OH﹣、Ba2+
C . Mg2+、Fe3+、Cl﹣、NO3﹣
D . Ca2+、SO42﹣、NO3﹣、HCO3﹣
下列各组离子,能大量共存于同一溶液中的是( )
A . CO32﹣、H+、Na+、NO3﹣
B . H+、Ag+、Cl﹣、SO42﹣
C . K+、Na+、OH﹣、NO3﹣
D . Ba2+、Ca2+、SO42﹣、OH﹣
下列各组离子在水溶液中能够大量共存的是( )
A . H+、SO42― 、SO32―
B . Ba2+、CO32―、N O3―
C . Na+、Cl-、SO42―
D . Ca2+、SO42―、K+
下列关于离子共存或离子反应的说法正确的是( )
A . 某无色溶液中可能大量存在H+、Cl-、MnO4-
B . pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C . Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D . 稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
已知氧化性:Cl2>Fe3+>I2>S,在强酸性溶液中,下列各组离子能大量共存的是( )
A . Na+、K+、I-、Cl-
B . Na+、I-、SO42-、Fe3+
C . Ba2+、K+、HCO3-、NO3-
D . Ba2+、Na+、SO42-、Cl-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A . 使甲基橙呈红色的溶液中:Fe2+、NO3-、SO42-、Na+
B . c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
C . 由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、H2PO4-
D . c(Fe3+)=0.1 mol·L-1的溶液中:K+、CO32-、NO3-、S2-
在无色溶液中,下列离子能大量共存的是( )
A . Mg2+、SO42-、K +、Cl-
B . Na+ 、NH4+ 、NO3-、MnO4-
C . K + 、Cu2+ 、Cl-、Br-
D . Mg2+ 、Na+ 、OH-、HCO3-
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的( )

A . 溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B . 溶液中一定不含CO32-和NO3- , 一定含有SO42-
C . 溶液中c(NH4+)=0.3mol·L-1
D . c(H+):c(Al3+):c(Mg2+)=1:1:1
下列离子方程式书写正确的是( )
A . 用FeCl3溶液腐蚀铜线路板:Cu + Fe3+ = Cu2+ + Fe2+
B . Na2O2固体与H2O反应产生O2 :2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
C . Ba(OH)2溶液中加入稀硫酸 Ba2+ + OHˉ + H+ + SO42-= BaSO4↓+ H2O
D . 向氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
镁、铝、铜三种金属混合物粉末,加入过量盐酸充分反应过滤后,向滤液中加入过量烧碱溶液,再过滤,滤液中(除Na+、Cl-外)存在大量离子有( )
A . Mg2+
B . Cu2+
C . Al3+
D . AlO2-
向下列溶液中加入足量Na2O2后,仍能共存的离子是( )
A . K+、AlO2-、SO42-、Cl-
B . Na+、Cl-、CO32-、SO32-
C . Ca2+、Mg2+、HCO3-、NO3-
D . NH4+、Ba2+、Cl-、NO3-
已知氧化性顺序是:Cl2>Br2>Fe3+>I2 , 在FeI2和FeBr2混合溶液中,通入一定量Cl2 , 溶液中存在的离子组合不合理的是( )
A . Fe3+、Br-、Cl-
B . Fe3+、Cl-
C . Fe2+、Cl-、I-
D . Fe2+、Br-、Cl-、I-
在指定环境中,下列各组离子一定可以大量共存的是( )
①pH试纸变成深蓝色的溶液中:SO  、S2O
、S2O  、Na+
、Na+
②含有大量S2-的溶液中:Na+、ClO-、Cl-、CO 
③AlCl3溶液中:K+、SiO  、NH
、NH  、NO
、NO 
④中性溶液中:Cu2+、Fe3+、SO  、Cl-
、Cl-
⑤加入铝粉放出氢气的溶液:Na+、Cl-、NH  、NO
、NO 
⑥在含有大量HCO  的溶液中:K+、Na+、AlO
的溶液中:K+、Na+、AlO  、Br-
、Br-
A . ①③④
B . 只有①
C . ②④⑤
D . ①④⑥
下列离子能在溶液中大量共存的是( )
A . Na+、Ca2+、  、
、  B . Na+、
B . Na+、 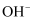 、
、  、Mg2+
C .
、Mg2+
C .  、
、  、K+、Cu2+
D .
、K+、Cu2+
D . 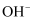 、K+、H+、
、K+、H+、 
 、
、  B . Na+、
B . Na+、 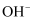 、
、  、Mg2+
C .
、Mg2+
C .  、
、  、K+、Cu2+
D .
、K+、Cu2+
D . 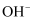 、K+、H+、
、K+、H+、 
最近更新



