化学平衡中反应条件的控制 知识点题库
某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图Ⅱ所示.则下列结论正确的是( )


A . 该反应的热化学方程式为:A(g )+3B(g) ⇌2C(g);△H>0
B . 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C . 达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D . 若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
A,B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)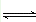 zC(g)△H<0.达到化学平衡后测得A的浓度为0.5mol•L﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9mol•L﹣1 . 则下列有关判断正确的是( )
zC(g)△H<0.达到化学平衡后测得A的浓度为0.5mol•L﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9mol•L﹣1 . 则下列有关判断正确的是( )
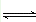 zC(g)△H<0.达到化学平衡后测得A的浓度为0.5mol•L﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9mol•L﹣1 . 则下列有关判断正确的是( )
zC(g)△H<0.达到化学平衡后测得A的浓度为0.5mol•L﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9mol•L﹣1 . 则下列有关判断正确的是( )
A . 平衡向正反应方向移动了
B . x+y<z
C . B的转化率下降
D . C的体积分数减小
可逆反应达到平衡状态的主要特征是( )
A . 正、逆反应的速率均为零
B . 正、逆反应都还在进行
C . 正、逆反应的速率相等
D . 反应停止了
在一定温度下,固定容积的容器中加入a mol A和b mol B,发生反应:A(g)+2B(g)⇌2C(g)一段时间后达到平衡,生成n mol C.则下列说法中不正确的是( )
A . 再充入少量A,平衡向正反应方向移动,但K值不变
B . 起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b﹣ 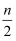 )
C . 当2v正(A)=v逆(B)时,反应一定达到平衡状态
D . 充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
)
C . 当2v正(A)=v逆(B)时,反应一定达到平衡状态
D . 充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
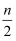 )
C . 当2v正(A)=v逆(B)时,反应一定达到平衡状态
D . 充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
)
C . 当2v正(A)=v逆(B)时,反应一定达到平衡状态
D . 充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
COCl2的分解反应为COCl2(g)⇌Cl2(g)+CO(g).将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的量在不同条件下的变化情况如图所示.下列相关说法中不正确的是( )

A . 1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率
B . 若在6min时改变的条件为升高温度,则反应的平衡常数K增大
C . 12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积
D . 以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13)
某恒温密闭容器发生可逆反应:Z(?)+W(?)⇌X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )

A . Z和W在该条件下至少有一个是为气态
B . t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等
C . 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
D . 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
将物质的量均为2.0mol的物质X、Y混合,发生如下反应:2X(g)+Y(g)⇌2W(g).在反应过程中W的物质的量分数随温度变化如图所示,下列判断不正确的是( )

A . T0对应的V(正)和V(逆)的关系是:V(正)=V(逆)
B . 此反应的正反应为放热反应
C . A、B两点正反应速率的大小关系是:V(A)=V(B)
D . 若B点的W的物质的量分数为50.0%,则参加反应的X的物质的量为1.6mol
恒温下,在5L 的密闭容器中充入2molX气体和1molY气体发生反应:2X(g)+Y(g)⇌2Z(g);△H<0.10min 后达平衡,侧得容器内压强是反应前的 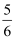 ,下列说法中错误的是( )
,下列说法中错误的是( )
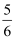 ,下列说法中错误的是( )
,下列说法中错误的是( )
A . 平衡时,X 的转化率为50%
B . 该握度下平衡常数K=10(10mol•L﹣1)﹣1
C . 10min内生成物Z 的反应速率0.02mol•L﹣1•min﹣1
D . 若Y是有色气体,只压缩容器的体积,则体系颜色变浅
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1 . 下列叙述中不正确的是( )
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1 . 下列叙述中不正确的是( )
 CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1 . 下列叙述中不正确的是( )
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1 . 下列叙述中不正确的是( ) 
A . 0~3 min内,v(CO2)正=v(CH3OH)正
B . 在T1℃时,若起始时向容器中充人2 moI CO2和6 mol H2 , 测得平衡时容器内压强为p2 , 则p2<2p1
C . 其他条件不变,若向平衡后的体系中充人1 mol氦气,体系压强增大,平衡将向正反应方向移动
D . T2℃时,上述反应平衡常数为4.2,则T2>T1
反应2SO2+O2⇌2SO3达到平衡后,再向反应器中充入由18O组成的氧气,经一段时间后,18O可能存在于( )
A . 生成的SO3中
B . O2和SO3中
C . 剩余的SO3中
D . O2、SO2和SO3中
可逆反应A(g)+B(g)⇌2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.

①由T1向T2变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
③反应在温度下达到平衡.
④此反应的正反应为热反应.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)⇌2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示.

请回答下列问题:
-
(1) 0~20min,A的平均反应速率为;8min时,v(正) v(逆).(填:“>”、“=”或“<”)
-
(2) 反应方程式中的x=,30min时改变的反应条件是.
-
(3) 20~30min时反应的平衡常数 30~40min时反应的平衡常数.(填:“>”、“=”或“<”).
用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)⇌N2(g)+CO2(g).某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
物质浓度(mol/L)时间(min) | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
-
(1) 10~20min以v(CO2)表示的反应速率为.
-
(2) 根据表中数据,计算T℃时该反应的平衡常数为(保留两位小数).
-
(3) 下列各项能作为判断该反应达到平衡标志的是 (填序号字母).A . 容器内压强保持不变 B . 2v正(NO)=v逆(N2) C . 容器内CO2的体积分数不变 D . 混合气体的密度保持不变
-
(4) 30min时改变某一条件,反应重新达到平衡,则改变的条件可能是.
-
(5) 一定温度下,随着NO的起始浓度增大,则NO的平衡转化率(填“增大”“不变”或“减小”).
向1 L的密闭容器中加入1 mol X、0.3 mol Z和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是( )

A . Y的起始物质的量为0.5 mol
B . 该反应的化学方程式为:2X(g)+Y(g)  3Z(g) ∆H<0
C . 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D . 反应物X的转化率t6点比t3点高
3Z(g) ∆H<0
C . 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D . 反应物X的转化率t6点比t3点高
 3Z(g) ∆H<0
C . 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D . 反应物X的转化率t6点比t3点高
3Z(g) ∆H<0
C . 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D . 反应物X的转化率t6点比t3点高
在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应A(s)+2B(g)⇌C(g)+D(g)已达平衡的是( )
A . 混合气体的压强
B . 混合气体的密度
C . 混合气体的相对分子质量
D . C气体的总物质的量浓度
氮氧化物会造成环境污染,我国科学家正着力研究SCR技术(NH3选择性催化还原氮氧化物)对燃煤电厂烟气进行脱硝处理。
-
(1) 氮氧化物(以NO为主)直接排放到空气中会形成硝酸型酸雨,反应的化学方程式为。
-
(2) NH3催化还原NO的化学方程式为。
-
(3) 铁基催化剂在260~300℃范围内实现SCR技术的过程如下:

① 反应iv中消耗的NO2 (NH
 ) 2与NO的物质的量之比为。
) 2与NO的物质的量之比为。② 适当增大催化剂用量可以明显加快脱硝速率,结合上述过程解释原因:。
③ 向反应体系中添加NH4NO3可显著提高NO脱除率。原因如下:
NO
 与NO发生反应NO
与NO发生反应NO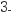 + NO = NO2 + NO
+ NO = NO2 + NO ;
;NO2与NH
 发生反应iii和反应iv转化为N2;
发生反应iii和反应iv转化为N2;NO
 与NH
与NH 发生反应(填离子方程式)转化为N2。
发生反应(填离子方程式)转化为N2。 -
(4) 相比于铁基催化剂,使用锰基催化剂(活性物质为MnO2)时,烟气中含有的SO2会明显降低NO脱除率。
① 推测SO2与MnO2会发生反应使催化剂失效,其化学方程式是。
② 持续通入含SO2的烟气。不同温度下,每隔1 h测定NO脱除率,结果如下:

相同时间,200℃时NO脱除率低于100℃,原因是。
在673K,30MPa下:N2(g)+3H2(g) 2NH3(g),上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g),上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
 2NH3(g),上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g),上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
A . 点d和点e处的n(H2)不相同
B . 点c处反应达到化学平衡状态
C . 点a的正反应速率比点b的大
D . 点e反应达到化学平衡状态,反应停止
工业合成乙醇的反应:C2H4(g)+H2O(g) 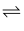 C2H5OH(g) ΔH<0,在催化剂、260-290℃。和约7MPa的条件下进行。下列说法错误的是( )
C2H5OH(g) ΔH<0,在催化剂、260-290℃。和约7MPa的条件下进行。下列说法错误的是( )
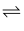 C2H5OH(g) ΔH<0,在催化剂、260-290℃。和约7MPa的条件下进行。下列说法错误的是( )
C2H5OH(g) ΔH<0,在催化剂、260-290℃。和约7MPa的条件下进行。下列说法错误的是( )
A . 循环使用乙烯是为了提高乙烯的利用率
B . 原理分析表明合成时压强越大越好,但实际生产中还要考虑安全、成本等因素
C . 其他条件不变时,投料比n(H2O)∶n(C2H4)越小,乙烯的平衡转化率越大
D . 寻找高活性的催化剂是研究该反应的重要方向
反应物(S)转化为产物(P或 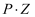 )的能量与反应进程的关系如下图所示:
)的能量与反应进程的关系如下图所示:
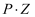 )的能量与反应进程的关系如下图所示:
)的能量与反应进程的关系如下图所示:
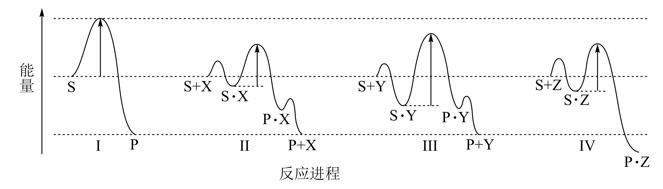
下列有关四种不同反应进程的说法正确的是( )
A . 进程Ⅰ是放热反应
B . 平衡时P的产率:Ⅱ>Ⅰ
C . 生成P的速率:Ⅲ>Ⅱ
D . 进程Ⅳ中,Z没有催化作用
利用 和
和 重整技术可获得合成气(主要成分为CO、
重整技术可获得合成气(主要成分为CO、 ),重整过程中部分反应的热化学方程式:
),重整过程中部分反应的热化学方程式:
 和
和 重整技术可获得合成气(主要成分为CO、
重整技术可获得合成气(主要成分为CO、 ),重整过程中部分反应的热化学方程式:
),重整过程中部分反应的热化学方程式:反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

不同 配比随温度变化对出口合成气中
配比随温度变化对出口合成气中 的影响如图所示。
的影响如图所示。

下列说法正确的是( )
A . 对于反应Ⅰ,M点的平衡常数大于N点
B . 高温高压有利于提高原料的平衡转化率
C . 使用合适的催化剂并不能提高合成气的产率
D . 当 时,温度高于900℃后
时,温度高于900℃后 减小是由反应Ⅱ导致的
减小是由反应Ⅱ导致的
 时,温度高于900℃后
时,温度高于900℃后 减小是由反应Ⅱ导致的
减小是由反应Ⅱ导致的
最近更新



