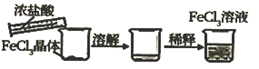
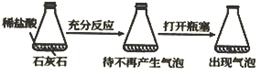
化学平衡的调控 知识点题库
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
下列判断正确的是( )
在容积固定且为2L的密闭容器中进行反应:N2(g)+3H2(g)=2NH3(g)△H=﹣92.4kJ/mol,恒温条件下,体系中某两种物质的物质的量随时间关系图,回答下列问题:
(1)图象中a、b、c、d四点,其中处于平衡状态的点有
(2)用H2表示15分钟内的反应速率为v(H2)= .达到平衡状态时,下列说法不正确的是
A.2v(N2)正=v(NH3)逆
B.容器的总压强不再随时间而变化
C.N2、NH3的分子数之比保持1:2不变
D.混合气体的摩尔质量保持不变
E.充入少量He时平衡体系中H2的体积百分含量将会减小
(3)25min时采用的措施是 ;若从a点时刻改变某一条件,以实现达到d点时的状态,此时KbKd(填“<”、“>”或“=”).
(4)以N2、H2为电极反应物,以1L浓度均为0.05mol•L﹣1的HCl﹣NH4Cl混合液为电解质溶液的燃料电池,请写出电池工作时的正极反应式: .已知NH3•H2O在常温下的电离平衡常数为K,N2﹣H2燃料电池工作一段时间后溶液的pH=7,求电路中通过的电子的物质的量为 (用含K的代数式表示,假设NH3与H2O完全转化为NH3•H2O且忽略溶液体积的变化).


上述合成塔和接触室中的反应分别为:
N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ/mol;
2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ/mol
-
(1) 进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是.
-
(2) 采用循环操作可以提高原料的利用率,下列工业生产中,采用循环操作的是(填写序号).
①硫酸工业 ②合成氨工业 ③硝酸工业 ④氯碱工业
-
(3) 根据化学平衡移动原理来确定的条件或措施有(填写序号).
①合成氨工业在高压下进行;
②硫酸工业的催化氧化在常压下进行;
③合成氨工业及时将氨液化分离;
④硫酸工业净化后的炉气中含有过量空气;
⑤硫铁矿石加入沸腾炉之前先粉碎;
⑥吸收塔中用98.3%的浓硫酸吸收SO3
⑦合成氨工业和硫酸工业都使用催化剂;
⑧合成氨工业和硫酸工业都用适宜的温度
-
(4) 硫酸工业尾气直接排放到空气中会造成环境污染,其后果主要是.处理硫酸工业尾气的一种常用方法是“氨﹣酸”法,写出这种尾气处理方法的化学方程式.有人研究用Na2SO3作为治理SO2污染的一种新方法,该方法的第一步是用Na2SO3水溶液吸收SO2 , 第二步是加热吸收溶液,使之重新生成Na2SO3 , 同时得到含高浓度SO2的水蒸气副产品.这种尾气处理方法与“氨一酸”相比的优点是.
-
(5) 若经净化、干燥处理后进入接触室的气体体积组成是:SO2 7%,O2 11%,N2 82%,从接触室出来的气体中SO3的体积分数为7%,则SO2的转化率为(保留三位有效数字).
实验目的 | 实验步骤和装置 | |
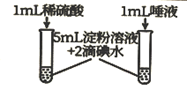
A | 探究温度对反应速率的影响 | 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间 |
B | 配制100mL1.0mol/L NaOH溶液 | 向100mL容量瓶中加入4. 0gNaOH固体,加水到刻度线 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 比较H2O2 和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
 2Z(g)、②2M(g)
2Z(g)、②2M(g)  N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: 
下列判断正确的是( )
 2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同( )
2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同( )
 。加入少量下列物质,能使平衡逆向移动的是( )
。加入少量下列物质,能使平衡逆向移动的是( )
 B .
B .  C .
C .  D .
D . 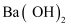

下列叙述正确的是( )


-
(1) 已知:CH4的燃烧热
 ,
,  的蒸发热
的蒸发热 
则氧再生反应的

-
(2) 恒压条件时,按
 投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。
投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。 
①若
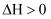 ,则曲线代表CH4。
,则曲线代表CH4。②350℃时,A点的平衡常数为
 (填计算结果),为提高CO2的转化率,除改变温度外,还可采取的措施为。
(填计算结果),为提高CO2的转化率,除改变温度外,还可采取的措施为。③关于以上反应,下列说法正确的是(填字母)。
a.CH4和CO2浓度相等时可判断反应到达平衡状态
b.消耗1 mol CO2同时断裂4 mol C-H键可判断反应到达平衡状态
c.平衡后,按起始原料比再充入反应物,维持温度不变,再次达平衡时,甲烷的体积分数不变
d.若体系改为恒温恒容,反应物起始投料比不变,CO2的平衡转化率减小
-
(3) 氧再生反应可以通过酸性条件下半导体光催化转化实现;反应机理如图所示:

①光催化CO2转化为CH4的阴极方程式为。
②催化剂的催化效率和CH4的生成速随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是。
反应I:C(s)+H2O(g)  CO(g)+H2(g)△H1
CO(g)+H2(g)△H1
反应II:CO(g)+H2O(g)  CO2(g)+H2(g)△H2
CO2(g)+H2(g)△H2
回答下列问题:
-
(1) C(s)+2H2O(g)
 CO2(g)+2H2(g)∆H(用△H1和△H2表示)。改变条件,提高H2的产率,∆H(填“增大"“减小"或“不变")。
CO2(g)+2H2(g)∆H(用△H1和△H2表示)。改变条件,提高H2的产率,∆H(填“增大"“减小"或“不变")。
-
(2) 在2L恒容密闭容器中充入足量炭粉和1molH2O(g),在-定温度下发生反应I和反应II,达到平衡时测得c(CO)=0.20mol·L-1 , c(H2)=0.40mol·L-1。
①在该条件下,水蒸气的平衡转化率为。
②反应II的平衡常数Kp=。(用平衡体系中各组分的分压计算的平衡常数为Kp , 分压=总压×该组分体积分数)
-
(3) 在密闭容器中充入一定量的CO和水蒸气,加入适量催化剂,仅发生反应II。测得催化效率和CO转化率与温度关系如图所示。在600℃~750℃范围内影响CO转化率的主要因素是。

-
(4) 工业上常以水煤气(CO和H2)为原料合成甲醇。在一容积可变的密闭容器中充入1molCO与2molH2 , 在催化剂作用下发生反应CO(g)+2H2(g)
 CH3OH(g),△H<0,下列叙述不能说明反应已经达到化学平衡状态的是。
CH3OH(g),△H<0,下列叙述不能说明反应已经达到化学平衡状态的是。 A.H2的消耗速率是CH3OH生成速率的2倍
B.CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
为了提高H2的转化率,可采取的措施为(填两条即可)。
-
(5) 以水煤气(CO、H2体积比为1:2)为燃料的碱性(足量KOH为电解质)空气燃料电池,电池工作时CO发生反应的电极反应式为。
| A | 比较 | |
| B | 配制 | |
| C | 探究石灰石与稀盐酸在密闭环境下的反应 | |
| D | 淀粉在不同条件下水解 | |
 H++ OH-。下列叙述正确的是( )
H++ OH-。下列叙述正确的是( )
| 容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
| SO2 | O2 | SO3 | ||||
| I | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 |
| II | 绝热恒容 | 1.0 L | 2 | 1 | 0 | a |
| III | 恒温恒压 | 2.0 L | 0 | 0 | 4 | b |
 ,
,  随时间的变化如表,则下列说法正确的是( )
随时间的变化如表,则下列说法正确的是( )时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
 表示0~4
表示0~4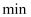 内该反应的平均速率为0.005
内该反应的平均速率为0.005 B . 当混合气体的平均摩尔质量不变时,该反应不一定达到平衡
C . 平衡时再通入
B . 当混合气体的平均摩尔质量不变时,该反应不一定达到平衡
C . 平衡时再通入 , 反应物活化分子百分数增大
D . 平衡时若升高温度,
, 反应物活化分子百分数增大
D . 平衡时若升高温度, 会减少
会减少
 , 若起始时按
, 若起始时按 和
和 物质的量比2:1投料,反应达到平衡时
物质的量比2:1投料,反应达到平衡时 的转化率(%)随温度和压强变化如下表:
的转化率(%)随温度和压强变化如下表:温度/℃ | 平衡时 | ||||
0.1MPa | 0.5MPa | 1MPa | 2.5MPa | 5MPa | |
400 | 99.2 | 99.6 | 99.7 | 99.8 | 99.9 |
450 | 97.5 | 98.9 | 99.2 | 99.5 | 99.6 |
500 | 93.5 | 96.9 | 97.8 | 98.6 | 99.0 |
下列说法错误的是( )
 和
和 的转化率始终相等
B . 降低温度或增大压强,可使
的转化率始终相等
B . 降低温度或增大压强,可使 的转化率达到100%
C . 其他条件不变,升高温度,正反应速率和逆反应速率均增大
D . 实际生产中,该反应常采用400~500℃、常压并使用催化剂
的转化率达到100%
C . 其他条件不变,升高温度,正反应速率和逆反应速率均增大
D . 实际生产中,该反应常采用400~500℃、常压并使用催化剂


 在不同温度水浴中的颜色
在不同温度水浴中的颜色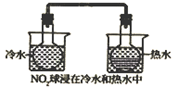
 溶液
溶液