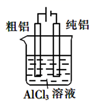
铜的电解精炼 知识点
铜的电解精炼:将粗铜预先制成厚板作为阳极,纯铜制成薄片作阴极,以硫酸和硫酸铜的混和液作为电解液,通电后,铜从阳极溶解成铜离子向阴极移动,到达阴极后获得电子而在阴极析出纯铜。粗铜中杂质如比铜活泼的铁和锌等会随铜一起溶解为离子,但由于这些离子活泼性弱于铜,与铜离子相比不易析出,所以电解时只要适当调节电位差即可避免这些离子在阳极上析出,比铜不活泼的杂质如金和银等沉积在电解槽的底部。这样生产出来的铜板,称为“电解铜”,纯度极高,可用来制作电气产品。
铜的电解精炼 知识点题库
下列有关化学工业原理说法正确的是( )
A . 电解精炼铜:阳极质量的减小等于阴极质量的增加
B . 氯碱工业:在阴极需要不断加入含有NaOH的蒸馏水
C . 合成氨工业:使用催化剂只加快反应速率不影响化学平衡
D . 硫酸工业:SO2的转化率高达93.5%~98%,因此接触氧化后的尾气可以直接排放
关于镀铜和电解精炼铜,下列说法中正确的是( )
A . 都用粗铜做阳极、纯铜做阴极
B . 电解液的成分都保持不变
C . 阳极反应都只有Cu﹣2e﹣═Cu2+
D . 阴极反应都只有Cu2++2e﹣═Cu
铜是人类最早发现和使用的金属之一,铜及其合金的用途广泛.粗铜中含有少量铁、锌、镍、银、金等杂质,工业上可用电解法精炼粗铜制得纯铜,下列叙述正确的是( )(已知:氧化性Fe2+<Ni2+<Cu2+)
A . 粗铜作阳极,其电极反应式:Cu2++2e﹣=Cu
B . 电解过程中,电解质溶液中c(Cu2+)不变
C . 电解后,阴极上还附有极少量的Fe和Ni
D . 电解后,可用阳极泥来提炼金、银等贵金属
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是( )
A . 电能全部转化为化学能
B . 粗铜接电源负极,发生氧化反应
C . 溶液中Cu2+向阳极移动
D . 利用阳极泥可回收Ag、Pt、Au等金属
下列有关工业生产的叙述正确的是( )
A . 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B . 硫酸工业中,为了提高SO2的转化率,用五氧化二钒作催化剂
C . 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D . 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是( )
A . 电解饱和食盐水时,阳极的电极反应式为:2Cl﹣﹣2e﹣═Cl2↑
B . 氢氧燃料电池的负极反应式:O2+4H++4e﹣═2H2O
C . 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu﹣2e﹣═Cu2+
D . 钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣═Fe2+
电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:
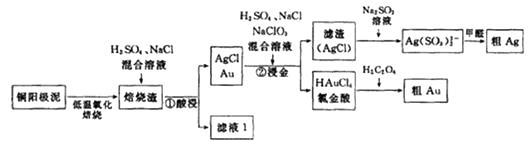
-
(1) 氯金酸(HAuCl4)中的Au的化合价为
-
(2) 铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是
-
(3) “焙烧渣”在“①酸浸”时发生反应的离子方程式为
-
(4) “②浸金”反应中,H2SO4的作用为,该步骤的分离操作中,需要对所得的AgCl进行水洗。简述如何判断AgCl已经洗涤干净?.
-
(5) 氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为
-
(6) 甲醛还原法沉积银,通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为电解法精炼银,用10A的电流电解30min,若电解效率(通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比)为80%,此时可得到银单质的质量为。(保留1位小数,法拉第常数96500C/mol)
以CuSO4溶液为电解质溶液进行粗铜(合Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是( )
A . 电能全部转化为化学能
B . 反应溶液中Cu2+向阳极移动
C . 粗铜接电源正极,发生氧化反应
D . 利用阳极泥可回收Zn、Ag、Pt、Au等金属
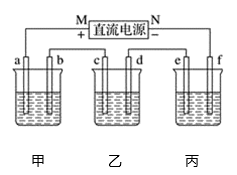
如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
-
(1) b极上的电极反应式为,甲电池的总反应化学方程式是。
-
(2) 在粗铜的电解过程中,图中c电极的材料是(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是,电解一段时间后,电解液中的金属离子有。
-
(3) 如果要在铁制品上镀镍(二价金属),则e电极的材料是(填“铁制品”或“镍块”,下同),f电极的材料是。
-
(4) 若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
下列措施中,不符合生产实际的是( )
A . 电解法精炼粗铜,用纯铜作阴扱
B . 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连
C . 为保护地下管道中的金属铁,可将其与锌极相连
D . 在镀件上电镀锌,用锌作阳极
设阿伏加德罗常数的值为NA , 下列说法正确的是( )
A . 标准状况下,2.24 L CH3OH分子中共价键的数目为0.5NA
B . 1 mol Na2O2与足量CO2充分反应,转移的电子数为2NA
C . 标准状况下,2.24 L NO与1.12 L O2混合后的气体分子数为0.1NA
D . 电解法精炼铜,阴极析出1 mol Cu时,阳极失去的电子数为2NA
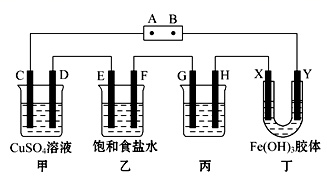
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是石墨电极。当将电源接通后,向乙中滴入酚酞试液,发现在F极附近溶液显红色。按要求回答下列问题:
-
(1) 电极F的名称是,电源B极的名称是。
-
(2) 甲装置中C电极的电极反应式是;D电极的电极反应式是。
-
(3) 乙装置中电解反应的总化学方程式。
-
(4) 欲使丙装置发生:2Ag+2HCl=2AgCl+H2↑反应,则G电极的材料应是 (填化学式)。
-
(5) 丁装置中装有Fe(OH)3胶体,一段时间后胶体颜色变深的电极是: (填字母)。
下列关于电解精炼铜与电镀的说法正确的是( )
A . 电解精炼铜时,将电能转化为化学能,电路中每通过2mole- , 阳极溶解64g铜
B . 可从阳极泥中提取金、银、锌等金属
C . 在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D . 电镀过程中电镀液需要不断更换
利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
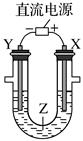
A . 铁片上镀铜时,Y是纯铜
B . 制取金属钠时,Y电极反应为Na+ +e-=Na
C . 电解精炼铜时,Z溶液中的Cu2+浓度不变
D . 电解饱和食盐水时,X极的电极反应式为4OH--4e-=2H2O+O2↑
利用如图所示装置模拟电解原理在工业生产中的应用,下列说法正确的是( )
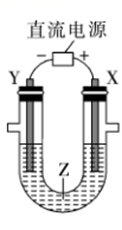
A . 氯碱工业中,X电极上的反应式是4OH--4e-=2H2O+O2↑
B . 电解精炼铜时,Z溶液中的Cu2+浓度不变
C . 在铁片上镀铜时,每转移2mol电子,Y极增重64g
D . 制取金属铝时,Z是熔融的氯化铝
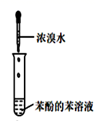
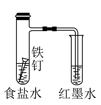
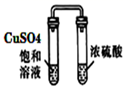
以下实验方案设计,能达到实验目的的是( )
| 选项 | A | B | C | D |
| 实验目的 | 除去苯中的苯酚 | 探究铁的吸氧腐蚀 | 验证浓硫酸的脱水性 | 电解精炼铝 |
| 实验方案 | | | | |
A . A
B . B
C . C
D . D
下列说法正确的是( )
A . 电解精炼铜时,电路中每通过 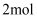
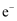 ,阴极析出
,阴极析出 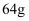 铜
B . 电解精炼铜时,粗铜中含有的
铜
B . 电解精炼铜时,粗铜中含有的 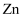 、
、  、
、 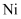 、
、 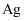 、
、 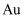 等杂质沉积在电解槽的底部
C . 外接电源保护水中钢闸门时,应将钢闸门与电源的正极相连
D . 白铁皮(镀锌铁)破损后,铁会迅速被腐蚀
等杂质沉积在电解槽的底部
C . 外接电源保护水中钢闸门时,应将钢闸门与电源的正极相连
D . 白铁皮(镀锌铁)破损后,铁会迅速被腐蚀
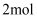
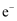 ,阴极析出
,阴极析出 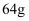 铜
B . 电解精炼铜时,粗铜中含有的
铜
B . 电解精炼铜时,粗铜中含有的 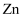 、
、  、
、 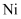 、
、 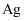 、
、 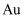 等杂质沉积在电解槽的底部
C . 外接电源保护水中钢闸门时,应将钢闸门与电源的正极相连
D . 白铁皮(镀锌铁)破损后,铁会迅速被腐蚀
等杂质沉积在电解槽的底部
C . 外接电源保护水中钢闸门时,应将钢闸门与电源的正极相连
D . 白铁皮(镀锌铁)破损后,铁会迅速被腐蚀
图I的目的是精炼铜,图II的目的是保护钢闸门。下列说法正确的是( )
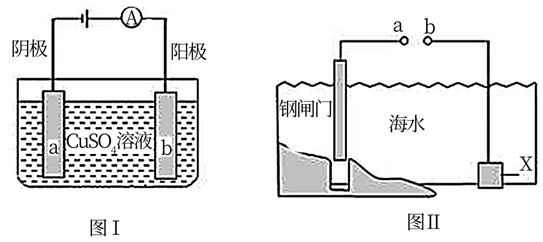

A . 图I中a为纯铜
B . 图I中 向a极移动
C . 图II中若a、b间连接电源,则a连接正极
D . 图II中若a、b间用导线连接,则X可以是铜
向a极移动
C . 图II中若a、b间连接电源,则a连接正极
D . 图II中若a、b间用导线连接,则X可以是铜
 向a极移动
C . 图II中若a、b间连接电源,则a连接正极
D . 图II中若a、b间用导线连接,则X可以是铜
向a极移动
C . 图II中若a、b间连接电源,则a连接正极
D . 图II中若a、b间用导线连接,则X可以是铜
如下图所示,某同学设计了一个燃料电池并探究铜的精炼原理和电镀原理。下列说法正确的是( )
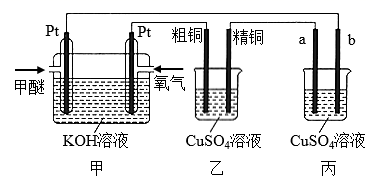
A . 一段时间后,甲装置中溶液 pH升高
B . 电解一段时间后,乙、丙装置中 CuSO4溶液的浓度均不变
C . 通入氧气的一极为正极,发生的电极反应为O2+4e-+4H+=2H2O
D . 丙装置中实现铁片上镀铜,b 应为铁片
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、比能量(即电池单位质量或者单位体积所输出电能的多少)高、效率好等优点,以此二甲醚燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
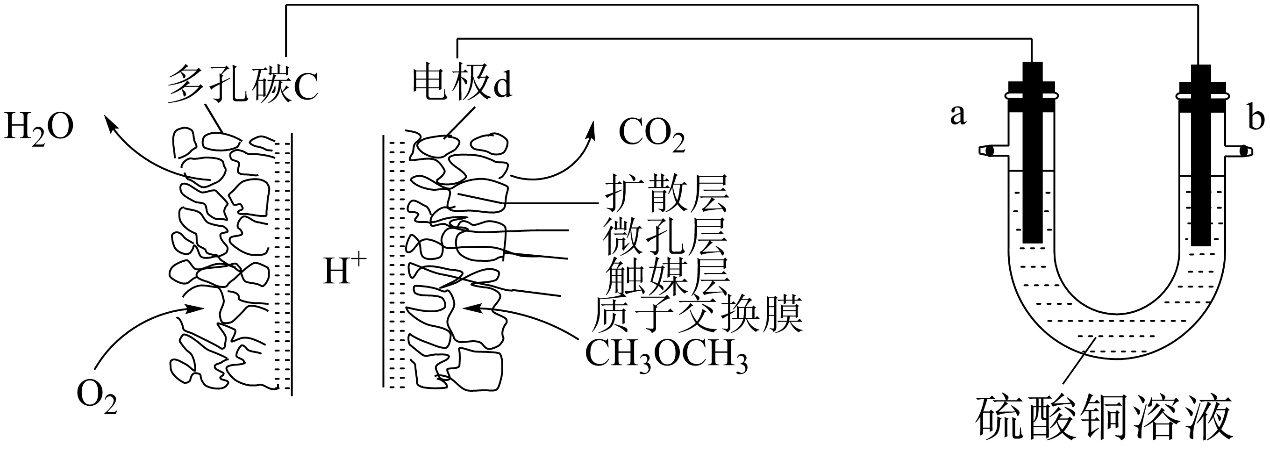
A . 多孔碳c能增大气固接触面积,提高反应速率,该电极为负极
B . 燃料电池工作时,电极d上发生的反应为:CH3OCH3+12e-+3H2O=2CO2+12H+
C . 二甲醚直接燃料电池的比能量(kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池比能量的1.4倍
D . a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同
最近更新