工业制金属铝 知识点
工业制金属铝:电解熔融Al2O3,Na3AlF6 冰晶石是助熔剂,能降低Al2O3的熔点。熔融氧化铝的中电离出自由移动的Al3+和O2-,在外加电源的作用下Al3+和O2-分别在阴、阳两极上放电得到对应的单质。熔融氧化铝的中自由移动的Al3+和O2-,其中O2-定向向阳极移动,在阳极上发生氧化反应:6 O2-- 12 e-=3O2↑;Al3+定向向阴极移动,在阴极上发生还原反应:4 Al3++ 12 e-=4 Al。
工业制金属铝 知识点题库
下列化工生产原理错误的是( )
①可以用电解熔融氯化钠的方法来制取金属钠 ②可以用钠加入硫酸铜饱和溶液中制取铜
③在电冶铝时,原料是氯化铝 ④炼铁高炉中所发生的反应都是放热的,故无需加热
A . ②③
B . ①③
C . ①②③
D . ②③④
工业上用铝土矿(主要成分为Al2O3 , 还有少量的Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
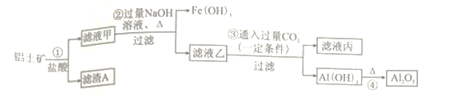
下列说法错误的是( )
A . 滤渣A主要成分为SiO2
B . 滤液乙含有的阴离子主要为[Al(OH)4]-、Cl-、OH-
C . 滤液丙中溶质的主要成分为Na2CO3
D . ④的基本反应类型为分解反应
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
-
(1) 铝粉和铁的氧化物(FeO·Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是。
-
(2) NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2 , 产生H2的离子方程式是。
-
(3) 工业上以铝土矿(Al2O3·H2O)为原料生产铝,主要包括下列过程:
i.将粉粹、筛选后的铝土矿溶解在NaOH溶液中;
ii.加入过量的试剂A使所得溶液中析出Al(OH)3固体;
iii.使Al(OH)3脱水生成Al2O3;
iv.电解熔融Al2O3生成Al。
铝土矿粉粹的目的是,电解熔融Al2O3时,加入冰晶石,其作用是。写出电解熔融Al2O3的化学方程式。
-
(4) 明矾化学式为KAl(SO4)2·12H2O,向明矾溶液中加入Ba(OH)2溶液,当溶液中的SO42-恰好沉淀时,铝元素的存在形式是。
工业上用铝土矿(主要成分为Al2O3 , 含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
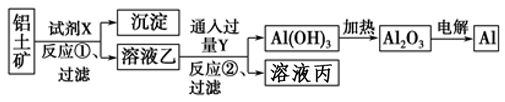
下列叙述正确的是( )
A . 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B . 反应①过滤后所得沉淀为氧化铁
C . 图中所有的转化反应都不是氧化还原反应
D . 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
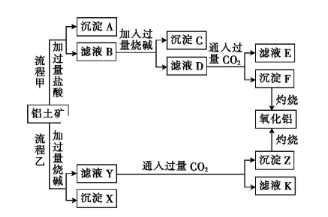
请回答下列问题:
-
(1) 流程甲加入盐酸后生成Al3+的离子方程式为。
-
(2) 灼烧用的仪器填名称)。
-
(3) 沉淀A的成分是(填化学式)。
-
(4) 冶炼铝的化学方程式。
下列物质性质与应用对应关系错误的是( )
A . 浓硝酸、浓盐酸均为易挥发的强酸,两者混合配成的“王水”具有强腐蚀性
B . 浓氨水具有挥发性,可用于检验运送氯气的管道是否发生泄露
C . 石墨具有导电性、稳定性,可用作电极材料
D . 氯化铝是电解质,可以用于电解法冶炼金属铝
按要求写出下列方程式
-
(1) 铝热反应冶炼金属铁的化学方程式:。
-
(2) 工业冶炼金属铝的化学方程式:。
-
(3) 铝片打磨后与氢氧化钠溶液反应的离子方程式:。
-
(4) 四氧化三铁与稀硝酸反应的离子方程式:。
-
(5) 向NH4Al(SO4)2溶液中滴加氢氧化钡溶液使SO
 恰好完全沉淀,写出反应的离子方程式:。
恰好完全沉淀,写出反应的离子方程式:。
下列有关物质性质的应用正确的是( )
A . 液氨汽化时要吸收大量的热,可用作制冷剂
B . 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C . 生石灰能与水反应,可用来干燥氯气
D . 氯化铝是一种电解质,可用于电解法制铝
工业上制备下列物质的生产流程不合理的是( )
A . 由黄铁矿制硫酸:黄铁矿  B . 由重晶石制可溶性钡盐:重晶石(BaSO4)
B . 由重晶石制可溶性钡盐:重晶石(BaSO4)  BaCO3
BaCO3  BaCl2(aq)
C . 由石英砂制高纯硅:石英砂
BaCl2(aq)
C . 由石英砂制高纯硅:石英砂  粗硅
粗硅 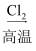 SiCl4
SiCl4  Si
D . 由铝土矿冶炼铝:铝土矿
Si
D . 由铝土矿冶炼铝:铝土矿  Al2O3
Al2O3 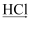 AlCl3(aq)
AlCl3(aq)  Al
Al
 B . 由重晶石制可溶性钡盐:重晶石(BaSO4)
B . 由重晶石制可溶性钡盐:重晶石(BaSO4)  BaCO3
BaCO3  BaCl2(aq)
C . 由石英砂制高纯硅:石英砂
BaCl2(aq)
C . 由石英砂制高纯硅:石英砂  粗硅
粗硅 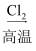 SiCl4
SiCl4  Si
D . 由铝土矿冶炼铝:铝土矿
Si
D . 由铝土矿冶炼铝:铝土矿  Al2O3
Al2O3 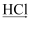 AlCl3(aq)
AlCl3(aq)  Al
Al
下列符合实际并用于工业生产的是( )
A . 工业炼铝:电解熔融的氯化铝
B . 制取漂粉精:将氯气通入澄清石灰水
C . 工业制硫酸:用硫磺为原料,经燃烧、催化氧化、最后用98.3%浓硫酸吸收
D . 工业制烧碱:电解饱和食盐水,在阳极区域得到烧碱溶液
下列关于物质的性质和应用的说法正确的是( )
A . 绿矾的化学式为 FeSO4·7H2O,可用作补血剂
B . 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
C . 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
D . 用 Na2S 作还原剂,除去水中的 Cu2+和 Hg2+
下列金属冶炼的反应原理,错误的是( )
A . 2Ag2O  4Ag+O2↑
B . Fe2O3+3CO
4Ag+O2↑
B . Fe2O3+3CO  2Fe+3CO2
C . 6MgO+4Al
2Fe+3CO2
C . 6MgO+4Al  6Mg+2Al2O3
D . 2NaCl(熔融)
6Mg+2Al2O3
D . 2NaCl(熔融)  2Na+Cl2↑
2Na+Cl2↑
 4Ag+O2↑
B . Fe2O3+3CO
4Ag+O2↑
B . Fe2O3+3CO  2Fe+3CO2
C . 6MgO+4Al
2Fe+3CO2
C . 6MgO+4Al  6Mg+2Al2O3
D . 2NaCl(熔融)
6Mg+2Al2O3
D . 2NaCl(熔融)  2Na+Cl2↑
2Na+Cl2↑
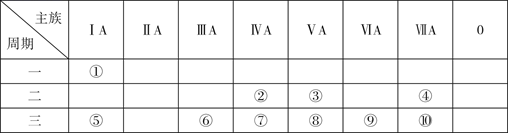
下表是元素周期表的一部分,针对表中的①~⑩十种元素,填写下列空白:
-
(1) 形成化合物种类最多的元素的原子结构示意图为,该元素有多种核素,其中一种考古时用于测定文物年代,请写出其原子符号。
-
(2) ③⑤⑦三种元素的单质中,熔点最高的是(写化学式),元素⑨的气态氢化物的电子式为,将⑩的单质通入该氢化物的水溶液中,发生反应的离子方程式为。
-
(3) 这十种元素中,非金属性最强的元素为(写元素符号);⑧⑨⑩三种元素的最高价氧化物对应的水化物中,酸性最弱的是(写化学式)。
-
(4) ⑤⑨⑩三种元素的简单离子半径,由大到小依次为(写离子符号)。
-
(5) 1889年,门捷列夫获得用元素⑥的单质制成的奖杯,以表彰其编制化学元素周期表的贡献。这种单质当时无比珍贵,如今已广泛使用。现在工业上冶炼该单质的化学方程式。
现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知:A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是其电子层数的3倍,C+和D3+的电子层结构相同,B与E属于同一主族。
-
(1) E在元素周期表中的位置是。
-
(2) 上述元素形成的简单离子中,半径最小的是 (填离子符号)。
-
(3) 下列事实能说明C元素的金属性比D元素的金属性强的是。
a.C单质常温能与水反应,D单质不能与水反应
b.在氧化还原反应中,1molD单质比1molC得电子多
c.C和D两元素的最高价氧化物的水化物,前者的碱性更强
-
(4) 写出由B和C形成的化合物C2B2的电子式为。
-
(5) 工业上用电解法制备D的单质,反应的化学方程式为。
-
(6) 写出实验室制备F单质的离子方程式。
下列有关判断正确的是( )
A . 金属阳离子被还原,一定会得到金属单质
B . 金属冶炼过程中,金属化合物得到电子发生氧化反应
C . 通过铝热反应可以在野外焊接钢轨
D . 工业上采用电解AlCl3的方法冶炼Al单质
下列金属的冶炼方法正确的是( )
A . .电解氯化钠溶液冶炼金属钠(电解法)
B . 用一氧化碳还原氧化铁冶炼铁(热还原法)
C . 电解熔融的氯化铝冶炼金属铝(电解法)
D . 用铝粉与氧化镁粉末高温下冶炼镁(铝热法)
工业上用铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3等杂质)提取氧化铝做冶炼铝的原料,其工艺流程如下图所示:
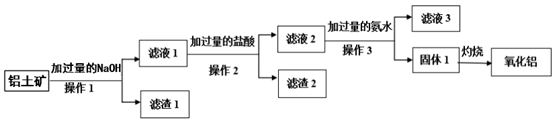
请回答下列问题。
-
(1) 操作1、2、3的名称均为。
-
(2) 滤液1中所含的阴离子除OH-外,还有、(填离子符号),滤渣2 的成分为(填化学式)。
-
(3) 滤液2中加入过量氨水生成固体1的离子反应方程式为。
-
(4) 滤液3中溶质的主要成分属于盐类的物质是、(填化学式)。
-
(5) 固体1灼烧发生反应的化学方程式为。
对于金属冶炼的工业方法。下列有关说法中正确的是( )
A . 可用电解饱和的MgCl2溶液的方法获得金属镁
B . 电解熔融Al2O3方法冶炼金属铝时,用铁做阳极
C . 电解熔融Al2O3方法冶炼金属铝时,同时要加入冰晶石作熔剂
D . 工业上常采用活泼金属还原法冶炼金属银
下列说法正确的是( )
A . 检验稀硫酸催化淀粉水解的产物为葡萄糖的方法是:向水解后的溶液中直接加入新制Cu(OH)2悬浊液,加热
B . 一定条件下,发生反应2H2 (g)+CO(g)  CH3OH(g),减小CH3OH的浓度,反应速率加快
C . 铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
D . 金属铝的冶炼流程为:铝土矿
CH3OH(g),减小CH3OH的浓度,反应速率加快
C . 铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
D . 金属铝的冶炼流程为:铝土矿 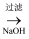 NaAlO2
NaAlO2  Al(OH)3
Al(OH)3 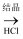 无水AlCl3
无水AlCl3  Al
Al
 CH3OH(g),减小CH3OH的浓度,反应速率加快
C . 铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
D . 金属铝的冶炼流程为:铝土矿
CH3OH(g),减小CH3OH的浓度,反应速率加快
C . 铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
D . 金属铝的冶炼流程为:铝土矿 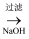 NaAlO2
NaAlO2  Al(OH)3
Al(OH)3 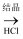 无水AlCl3
无水AlCl3  Al
Al
工业上用铝土矿(主要成分为  ,含
,含  杂质)为原料冶炼铝的工艺流程如图所示。下列叙述正确的是( )
杂质)为原料冶炼铝的工艺流程如图所示。下列叙述正确的是( )
 ,含
,含  杂质)为原料冶炼铝的工艺流程如图所示。下列叙述正确的是( )
杂质)为原料冶炼铝的工艺流程如图所示。下列叙述正确的是( ) 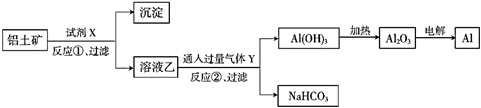
A . 试剂X是稀盐酸或稀硫酸
B . 反应①过滤后所得沉淀为氢氧化铁
C . 反应②通入的过量气体Y是  D . 试剂X是电解质
D . 试剂X是电解质
 D . 试剂X是电解质
D . 试剂X是电解质
最近更新



