浓硫酸的性质 知识点题库
某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜.制备方法如下:
Ⅰ.方法一:
-
(1) 浓硫酸试剂瓶上适合贴上的标签是(填序号).

-
(2) 甲同学取6.4 g铜片和10 mL 18 mol•L﹣1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀.甲同学为了验证其中白色沉淀主要成分.设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌.
实验现象:;
实验结论:所得白色固体的化学式为.
-
(3) 乙还观察到加热过程中,起初液面以上出现大量白色烟雾,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失.淡黄色固体消失的原因是(用化学反应方程式回答).直到最后反应完毕,发现试管中还有铜片剩余.乙根据自己所学的化学知识,认为试管中还有硫酸剩余.他这样认为的理由是.
-
(4) Ⅱ.方法二:
丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2
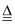 2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是①,②.
2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是①,②. -
(5) 方法三:
丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色.写出反应的化学反应方程式.
下列陈述Ⅰ、Ⅱ正确且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | Cl2有漂白作用 | Cl2能使湿润的有色布条褪色 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
D | 浓氨汽化时要吸收大量的热 | 浓氨可用作制冷剂 |
A . A
B . B
C . C
D . D
下列对有关实验事实的说明或解释正确的是( )
A . 浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,但原理不相同
B . 常温下,浓硫酸可以用铁制容器储存,说明铁与冷的浓硫酸不反应
C . 向某溶液中加入盐酸酸化的氯化钡溶液,生成白色沉淀,说明原溶液中一定含有SO  D . 向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+
D . 向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+
 D . 向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+
D . 向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+
某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.请根据实验回答问题:

-
(1) 首先根据图所示,组装实验装置,并在加入试剂前先进行操作.
-
(2) 烧杯中用NaOH溶液吸收的物质是利用倒置的漏斗而不是将导气管直接伸入烧杯中的目的是:.
-
(3) 加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:.
-
(4) 将充分反应后的烧杯取下,向其中加入足量的双氧水,再加入足量的BaCl2溶液,再进行、、后称量固体的质量为13.98g,请计算能与铜反应的硫酸的最低浓度是.
下列有关物质的性质和该性质的应用均正确的是( )
A . 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸
B . 二氧化硅不与任何酸反应,可用石英制造耐酸容器
C . 二氧化氯具有还原性,可用于自来水的杀菌消毒
D . 铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.

-
(1) 装置A中盛放浓硫酸的仪器名称.
-
(2) 装置A中发生反应的化学方程式为.
-
(3) 实验时,装置C中的现象为.
-
(4) 此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写).
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
-
(5) 当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2 , 而不是SO2;写出D中发生反应的化学方程式,当D中反应发生0.3mol电子转移时,发生反应的气体的体积(标准状况)是L.
下列变化中,体现浓硫酸的脱水性和强氧化性的是( )
A . 盛装浓硫酸的烧杯敞口放置一段时间后质量增加
B . 把铜片放入浓硫酸中并加热有气体产生
C . 常温下可用铁、铝容器盛装浓硫酸
D . 向蔗糖中加入浓硫酸,蔗糖变黑膨胀并有刺激性气味的气体放出
下列反应中,硫酸既表现出强氧化性,又表现出酸性的是( )
A . 稀硫酸与锌粒反应生成气体
B . 浓硫酸使铁、铝钝化
C . 浓硫酸与铜反应加热反应产生SO2
D . 浓硫酸和木炭在加热条件下反应
下列说法正确的是( )
A . 用30%的H2O2消除面部色斑
B . 当不慎在皮肤上沾上少量的浓H2SO4时,应立即用大量水冲洗,并涂上2%的NaHCO3溶液
C . 试样  白色沉淀
白色沉淀  白色沉淀不溶解,则试样中一定有SO42﹣
D . 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗
白色沉淀不溶解,则试样中一定有SO42﹣
D . 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗
 白色沉淀
白色沉淀  白色沉淀不溶解,则试样中一定有SO42﹣
D . 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗
白色沉淀不溶解,则试样中一定有SO42﹣
D . 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗
下列有关浓硫酸的认识正确的是( )
A . 浓硫酸具有吸水性,可用来干燥H2S
B . 浓硫酸在常温下不与铁和铝反应
C . 可将蒸馏水注入浓硫酸进行稀释
D . 棉花接触浓硫酸后会变黑
下列气体能用浓硫酸干燥的是( )
A . SO2
B . SO3
C . HI
D . H2S
下列知识梳理总结不合理的是( )
A . 卢瑟福发现原子中存在原子核,提出了“带核”的原子结构模型
B . 用一束光照射氢氧化铁胶体,可观察到丁达尔现象
C . 地球上 99%以上的溴元素存在海洋中,所以溴被称为“海洋元素”
D . 蔗糖中加入浓硫酸,变成“黑面包”,只体现了浓硫酸的脱水性
设NA为阿伏加德罗常数的值,下列叙述正确的是()
A . 7.8gNa2O2与足量水反应生成O2分子数为0.1NA
B . 50mL 18mol/L H2SO4溶液与足量的铜反应能产生SO2气体分子数为0.45NA
C . 标准状况下22.4 L氯气与足量的铁反应,转移电子数为3NA
D . 常温常压下,92g NO2气体中含有的原子总数为6NA
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是()
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | Fe3+有氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
A . A
B . B
C . C
D . D
浓硫酸具有的重要性质有:酸性、吸水性、脱水性、强氧化性。请把下列现象中浓硫酸表现出来的性质填写在对应的空白处:
-
(1) 把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现出:;
-
(2) 整有浓硫酸的烧杯敞口放置一段时间,质量增加,则浓硫酸表现出;
-
(3) 旅硫酸与碳共热时发生反应2H2SO4(浓)+C
 CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出。
CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出。
工业制硫酸铜的方法很多:
-
(1) 方法一:用浓硫酸和铜制取硫酸铜。该反应的化学方程式是。
-
(2) 方法二:实验证明,铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为。
-
(3) 以上两种方法(填“前”或“后”)者好,原因是。
-
(4) 方法三:用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸和氧化铁反应的离子方程式是(反应①);铜和上述反应(反应①)得到的物质反应的离子方程式是;向混合溶液中通入热空气的目的是;分离蓝色滤液和红褐色沉淀的实验操作是。
下表中,陈述Ⅰ、Ⅱ均符合题意且二者间具有因果关系的是( )
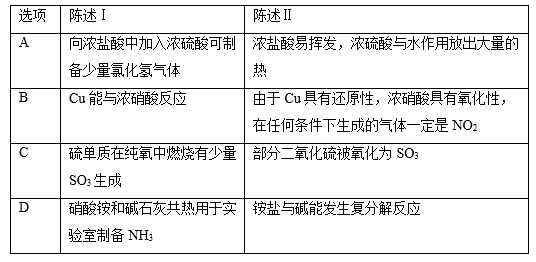
A . A
B . B
C . C
D . D
用CuCl2·2H2O晶体制取无水CuCl2的实验装置如图所示,下列说法错误的是( )

A . 通入HCl 可以抑制CuCl2 的水解
B . 先滴入浓硫酸,再点燃c 处酒精灯
C . 硬质玻璃管内部右侧会出现白雾
D . 装置d 中上层为苯,下层为NaOH 溶液
常温下,下列实验能发生化学反应,却始终无明显现象的是( )
A . 向FeSO4溶液中通入NO2
B . 向浓硫酸溶液中加入铜片
C . 向NaHCO3溶液中通入NH3
D . 向H2S溶液中通入SO2
下列对浓硫酸的叙述中,正确的是( )
A . 常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属
B . 浓硫酸和碳单质加热反应,表现出强氧化性
C . 浓硫酸具有吸水性,可以使蔗糖脱水炭化
D . 滴加浓硫酸使胆矾由蓝色晶体变为无色粉末,属于物理变化
最近更新



