pH的简单计算 知识点题库
下列溶液,按pH由小到大顺序排列的是( )
①0.1mol/L HCl溶液
②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液
④0.1mol/L CH3COOH溶液.
A . ①②④③
B . ②①④③
C . ②③④①
D . ④③②①
25℃时,pH=12的NaOH溶液100mL,要使它的pH为11.(溶液体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加0.01mol/L HCl,应加 mL.(精确到0.1)
FeCl3具有净水作用,但容易腐蚀设备;聚合氯化铁是一种新型絮凝剂,处理污水比FeCl3高效,且腐蚀性小.
-
(1) FeCl3腐蚀钢铁设备,除了H+作用外,另一主要原因是.(用离子方程式表示)
-
(2) 为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到含FeCl3的溶液.若酸性FeCl2废液中c(Fe2+)=2.0×10﹣2mol/L,c(Fe3+)=1.0×10﹣3mol/L,c(Cl﹣)=5.3×10﹣2mol/L,则该溶液的pH约为.
-
(3) 若在空气中加热FeCl3•6H2O,生成的是Fe(OH)Cl2 , 写出反应的化学方程式:;若在干燥的HCl气流中加热FeCl3•6H2O时,能得到无水FeCl3 , 其原因是.
-
(4) FeCl3在水中分三步水解(K为水解平衡常数):
Fe3++H2O⇌Fe(OH)2++H+K1
Fe(OH)2++H2O⇌Fe(OH)2++H+K2
Fe(OH)2++H2O⇌Fe(OH)3+H+K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是.
-
(5) 通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:xFe3++yH2O⇌Fex(OH)ym++yH+
欲使平衡朝正反应方向移动,可采用的方法是.
a.降温b.加水稀释c.加入NH4Cld.加入NaHCO3 .
将pH为5的硫酸溶液稀释500倍,稀释后溶液中c( 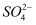 ):c(H+)约为( )
):c(H+)约为( )
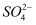 ):c(H+)约为( )
):c(H+)约为( )
A . 1:1
B . 1:2
C . 1:10
D . 10:1
一定温度下有:a.盐酸b.硫酸c.醋酸三种酸.
-
(1) 当其物质的量浓度相同时,c(H+)由大到小的顺序是.
-
(2) 同体积、同物质的量浓度的三种酸,中和NaOH能力的顺序是
-
(3) 当其c(H+)相同时,物质的量浓度由大到小的顺序为.
-
(4) 常温下,0.10mol•L﹣1 NH4Cl溶液pH7(填“>”、“=”或“<”).
-
(5) 相同物质的量浓度的Na2S溶液与NaHS溶液,pH大小:Na2SNaHS(填“>”、“=”或“<”).
-
(6) NaHCO3溶液呈碱性的原因是(用文字说明并写出有关的离子方程式).
在25℃时,某盐溶液中,C(OH﹣)=1×10﹣6mol/L,则该溶液的pH为( )
A . 1
B . 6
C . 8
D . 无法确定
下列各选项所描述的两个量中,前者一定大于后者的是( )
A . NH4NO3溶液中NH4+和NO3﹣的数目
B . 纯水在80℃和25℃时的pH
C . pH与体积都相同的氨水和NaOH溶液分别用0.1 mol•L﹣1盐酸恰好中和,所需的盐酸体积
D . 相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c (OH﹣)
下列有关说法正确的是( )
A . 镀锡铁制品镀层破损后铁不易被腐蚀
B . 相同温度下,pH相同的盐酸和硫酸中水的电离程度相同
C . 向饱和石灰水中滴加少量CuCl2溶液出现蓝色沉淀,则Ksp[Ca(OH)2]<Ksp[Cu(OH)2]
D . 合成氨生产中,需将NH3液化分离,目的是加快正反应速率,并提高H2转化率
常温下,将0.40mol/L氢氧化钠溶液与0.10mol/L硫酸溶液等体积混合,该混合溶液的pH为( )
A . 1.0
B . 2.0
C . 13.0
D . 14.0
常温下,下列说法正确的是( )
A . pH值都为4的稀盐酸和NH4Cl溶液中,水的电离程度相同
B . 浓度均为0.1mol/L的醋酸和NaOH溶液等体积混合后:lg[ 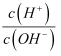 ]=0
C . 在含浓度都为0.01mol/L的Cl﹣、CrO42﹣的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.9×10﹣12]
D . 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同
]=0
C . 在含浓度都为0.01mol/L的Cl﹣、CrO42﹣的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.9×10﹣12]
D . 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同
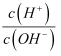 ]=0
C . 在含浓度都为0.01mol/L的Cl﹣、CrO42﹣的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.9×10﹣12]
D . 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同
]=0
C . 在含浓度都为0.01mol/L的Cl﹣、CrO42﹣的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.9×10﹣12]
D . 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同
常温下,某溶液中c(H+)=1×10﹣11mol/L,则该溶液的pH是( )
A . 3
B . 7
C . 8
D . 11
对于常温下1升pH=1 的硝酸溶液,下列叙述正确的是( )
A . 该溶液1mL稀释至100mL后,pH等于3
B . 向该溶液中加入含 0.1mol 氢氧化钡的溶液恰好完全中和
C . 该溶液中硝酸电离出的 c(H+)等于水电离出的c(H+)
D . 该溶液中硝酸电离出的 c(H+)是水电离出的c(H+)的100倍
-
(1) ① NH3 ②SO3 ③ Cl2 ④ BaSO4 ⑤酒精⑥ CH3COONH4 ⑦HClO⑧Cu,以上物质中 属于非电解质的是,属于强电解质的是(填入编号)
-
(2) 已知醋酸和盐酸是极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ 。
①下列方法中,可以使 0.1mol/CH3COOH的电离程度增大的是。
a. 加入少量 0.1mol/L的稀盐酸 b. 加入少量 0.1mol/LCH3COOHc. 加水稀释至 0.01mol/L d. 加入少量冰醋酸e. 加入少量醋酸钠固体 f. 加入少量 0.1mol/L的NaOH溶液
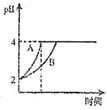
②常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn粒质量为m1 , 醋酸溶液中加入的Zn粒质量为m2 , 则m1m2(填“<”、“=”、“>”)。
现有室温下四种溶液,有关叙述错误的是( )
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A . 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B . 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C . ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D . VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是( )

A . BOH属于弱碱
B . BOH的电离常数K=1×10-4.8
C . P点所示的溶液中:c(Cl-)>c(B+)
D . N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
物质的量浓度均为1mol/L的①NaOH ②Ba(OH)2 ③Na2CO3 ④Na2SiO3四种溶液,pH由小到大的顺序是( )
A . ④③②①
B . ③④①②
C . ①②③④
D . ①②④③
常温下,向100mL0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,混合溶液的pH变化情况如图所示(体积变化忽略不计)。下列有关叙述正确的是( )

A . HA为弱酸
B . N点混合的溶液中,c(M+)=c(A-)=c(H+)=c(OH-)
C . K点的混合溶液中,c(M+)>c(A-)>c(OH-)>c(H+)
D . K点时加水稀释溶液,c(H+)减小
某温度下,水的离子积常数Kw=1×10-13。在该温度下,将pH=4的H2SO4溶液与pH=11的NaOH溶液混合并保持恒温,欲使混合溶液呈中性,则H2SO4与NaOH溶液的体积之比为( )
A . 1:10
B . 10:1
C . 100:1
D . 1:100
室温下,向  盐酸中滴加
盐酸中滴加  溶液,溶液的
溶液,溶液的  随
随 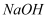 溶液体积的变化如图.已知
溶液体积的变化如图.已知  .下列说法不正确的是( )
.下列说法不正确的是( )
 盐酸中滴加
盐酸中滴加  溶液,溶液的
溶液,溶液的  随
随 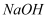 溶液体积的变化如图.已知
溶液体积的变化如图.已知  .下列说法不正确的是( )
.下列说法不正确的是( ) 
A . 选择甲基红指示反应终点,误差比甲基橙的大
B . 选择变色范围在  突变范围内的指示剂,可减小误差
C .
突变范围内的指示剂,可减小误差
C .  与盐酸恰好完全反应时,
与盐酸恰好完全反应时,  D .
D .  时,
时, 
 突变范围内的指示剂,可减小误差
C .
突变范围内的指示剂,可减小误差
C . 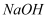 与盐酸恰好完全反应时,
与盐酸恰好完全反应时,  D .
D .  时,
时, 
常温下c(H+)最小的是( )
A . pH=0的溶液
B . 0.04 mol·L-1 H2SO4
C . 0.5 mol·L-1 HCl
D . 0.05 mol·L-1的HNO3
最近更新



