制取氢氧化铁、氢氧化亚铁 知识点题库
 B . 比较两种物质的热稳定性
B . 比较两种物质的热稳定性 C . 实验室制取NH3
C . 实验室制取NH3 D . 分离沸点不同且互溶的液体混合物
D . 分离沸点不同且互溶的液体混合物

方法一 用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 .
(2)除去蒸馏水中溶解的O2常采用 的方法.
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是 .
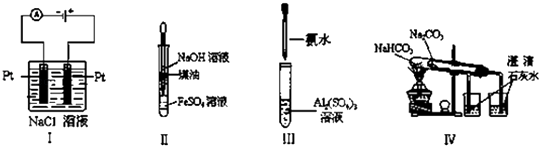
方法二 在如图1所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
(1)在试管Ⅰ里加入的试剂是 .
(2)在试管Ⅱ里加入的试剂是 .
(3)为了制得Fe(OH)2白色沉淀,在 在 试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,理由是
方法三 利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图2所示,已知两电极的材料分别为石墨和铁.
(1)a电极的材料应为 ,电极反应式为 .
(2)电解液c可以是 (填编号).
A.纯水 B.NaCl溶液C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 , 在加入苯之前对电解液c应作何简单处理? .
(4)若c用Na2SO4电解一段时间后看到白色Fe(OH)2沉淀,再反接电源电解,除了电极上看到气泡外,另一明显现象为 .

请回答下列问题:
-
(1) A是.
-
(2) 反应①~⑤中,属于氧化还原反应的是填序号).
-
(3) 反应⑤的化学方程式为;甲与B反应的离子方程式为.
-
(4) 在空气中将C溶液滴入F溶液中,观察到的现象是.

请问答下列问题:
-
(1) 反应①-⑤中,既属于氧化还原反应又属于化合反应的是(填序号)。
-
(2) 反应⑤的化学方程式为。
-
(3) 甲与B反应的离子方程式 。
-
(4) 在实验室将C溶液滴入F溶液中,观察到的现象是
-
(5) 在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:。

-
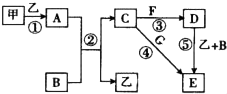
(1) Ⅰ.已知A为常见的金属单质,各物质之间有下图所示的关系:

确定A,B,C,D,E,F的化学式:
A为,
B为,
C为,
D为,
E为,
F为。
-
(2) 写出③、④、⑤的离子方程式:
③,
④,
⑤。
-
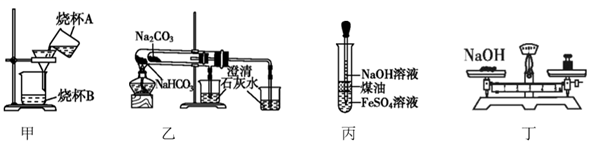
(3) Ⅱ.如图装置,用来制取和观察Fe(OH)2在空气中被氧化的颜 色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:

B中盛有一定量的NaOH溶液,A中应预先加入的试剂是,A中反应的离子方程式。
-
(4) 实验开始时应先将活塞a(填“打开”或“关闭”)。
-
(5) 简述生成Fe(OH)2的操作过程:。
-
(6) 实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为。
 B . 用如图装置可以制备沉淀Fe(OH)2
B . 用如图装置可以制备沉淀Fe(OH)2  C . 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色。结论:该Fe(NO3)2试样已经变质
D . Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤
C . 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色。结论:该Fe(NO3)2试样已经变质
D . Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤

-
(1) I.NaNO2和食盐外观很像,曾出现误把NaNO2当食盐而造成人员中毒的事情,在酸性溶液中它也是一种氧化剂,如NaNO2能把Fe2+氧化成Fe3+。已知NaNO2水溶液呈碱性,AgNO2是一种难溶于水白色固体。NaCl溶液呈中性。试回答下列问题:
人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐,如NaNO2 , 则导致血红蛋白中的Fe2+转化为Fe3+而中毒(FeCl2溶液为浅绿色,FeCl3溶液为棕黄色),可以服用维生素C解毒,维生素C在解毒的过程中表现出(填“氧化”或“还原”)性。
-
(2) 下列方法中,不能用来区分NaNO2和NaCl的是__________。A . 测溶液的酸碱性 B . 加入AgNO3溶液观察是否有沉淀生成 C . 分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
-
(3) II. H3PO2是精细磷化工产品。工业制备原理如下:
a.2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
b.Ba(H2PO2)2+H2SO4=BaSO4↓+2H3PO2
下列推断正确的是__________
A . 反应a是氧化还原反应,反应b是复分解反应 B . H3PO2中P化合价是+1 C . 在反应a中发生氧化反应与还原反应的原子个数之比为1:1 -
(4) 某离子反应涉及到H2O、ClO-、NH
 、OH-、N2、Cl-等微粒,其中N2、ClO-的粒子数随时间变化的曲线如图所示,请写出反应的离子方程,ClO-表现出性。
、OH-、N2、Cl-等微粒,其中N2、ClO-的粒子数随时间变化的曲线如图所示,请写出反应的离子方程,ClO-表现出性。 
-
(5) 用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴滴入物质M的饱和水溶液,继续煮沸至液体呈红褐色,停止加热。写出该过程反应的化学方程式。
 溶液水解法制备氢氧化铁胶体
B .
溶液水解法制备氢氧化铁胶体
B .  的“喷泉实验”说明
的“喷泉实验”说明  能大量、快速地溶于水
C . 氯仿(
能大量、快速地溶于水
C . 氯仿( 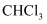 )与HF反应生成的
)与HF反应生成的 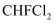 有两种不同结构
D . 甲基与苯环直接相连时可活化苯环,使苯环上的氢原子易被取代
有两种不同结构
D . 甲基与苯环直接相连时可活化苯环,使苯环上的氢原子易被取代


 Fe(OH)3(胶体)+3HCl
B . 滤纸上残留的红褐色物质为Fe(OH)3固体颗粒
C . 在B区的深红褐色分散系为Fe(OH)3胶体
D . 进入C区的H+的数目为0.03NA
Fe(OH)3(胶体)+3HCl
B . 滤纸上残留的红褐色物质为Fe(OH)3固体颗粒
C . 在B区的深红褐色分散系为Fe(OH)3胶体
D . 进入C区的H+的数目为0.03NA
 沉淀,请回答下列问题:
沉淀,请回答下列问题: 
-
(1) 分液漏斗、大具支试管、小具支试管分别盛装的物质是、、 (填编号)。
A.还原铁粉 B.浓硫酸 C.稀硫酸 D.氢氧化钠溶液
-
(2) 制备
 操作:实验过程中产生的气体从(填“开关①”或“开关②”)导出,赶出装置中的氧气;待氧气全部赶尽后,再关闭(填“开关①”或“开关②”),打开(填“开关①”或“开关②”),得到
操作:实验过程中产生的气体从(填“开关①”或“开关②”)导出,赶出装置中的氧气;待氧气全部赶尽后,再关闭(填“开关①”或“开关②”),打开(填“开关①”或“开关②”),得到  沉淀。
沉淀。
-
(3) 待保护气体失去作用后,白色沉淀会转化为灰绿色,最终变成红褐色,该化学方程式为。
-
(4) 研究发现
 被氧气氧化的反应速率与
被氧气氧化的反应速率与  大小有关,室温下其他条件相同时,
大小有关,室温下其他条件相同时,  为3的氧化速率(填“大于”、“等于”或“小于”)
为3的氧化速率(填“大于”、“等于”或“小于”)  为11的氧化速率。
为11的氧化速率。
 )分子的气体。可用于金属刻蚀,污水处理等。主要有以下制备方法:
)分子的气体。可用于金属刻蚀,污水处理等。主要有以下制备方法:方法①:氯化法。以废铁屑和氯气为原料,在立式反应炉里反应,生成的氯化铁蒸气和尾气由炉的顶部排出,进入捕集器冷凝为固体结晶。
方法②:熔融法。将铁屑和干燥氯气在低共熔混合物(如30%KCl与70%FeCl3混合)内进行反应生成氯化铁,升华后收集在冷凝室中,该法制得的氯化铁纯度高。
方法③:复分解法。用氧化铁与盐酸反应后得到氯化铁溶液。
方法④:氯化亚铁合成法。将铁屑溶于盐酸中,然后向其中通入氯气得到氯化铁。
下列说法正确的是( )



