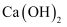气体的收集 知识点题库
下图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是( )

A . NO
B . O2
C . CO
D . SO2
不能用排水收集法收集的气体是( )
A . 氢气
B . 氧气
C . 二氧化氮
D . 一氧化氮
有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)
-
(1) 能用做干燥二氧化硫气体的装置有(填代号,下同)
-
(2) 既能用于收集氯气又能用于收集一氧化氮气体的装置有
-
(3) 在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有
-
(4) 在乙烯与溴水反应制二溴乙烷的实验中,能添加在制乙烯装置和加成反应装置之间,达到控制气流使其平衡目的是
-
(5) 若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是.
下列气体可用向上排空气法收集的是( )
A . NH3
B . H2
C . Cl2
D . CH4
下列装置或操作能达到相应实验目的的是( )
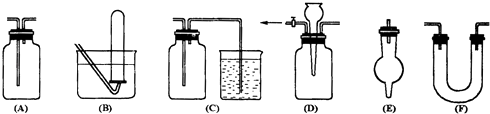
A .  排水集气法收集NO
B .
排水集气法收集NO
B .  实验室制取氨气
C .
实验室制取氨气
C .  检查装置气密性
D .
检查装置气密性
D .  配制稀硫酸
配制稀硫酸
 排水集气法收集NO
B .
排水集气法收集NO
B .  实验室制取氨气
C .
实验室制取氨气
C .  检查装置气密性
D .
检查装置气密性
D .  配制稀硫酸
配制稀硫酸
下列气体不能用排空气法收集,但可以用排水法收集的是( )
A . NO
B . NO2
C . CO2
D . O2
下列气体可用如图所示方法收集的是( )

A . H2
B . CO2
C . NO
D . NH3
下列制备NH3并制取氨水的装置正确且能达到实验目的的是( )
A . 制取NH3 B . 干燥NH3
B . 干燥NH3  C . 收集NH3
C . 收集NH3  D . 吸收氨水
D . 吸收氨水 
 B . 干燥NH3
B . 干燥NH3  C . 收集NH3
C . 收集NH3  D . 吸收氨水
D . 吸收氨水 
用下列装置进行的实验,不能达到相应实验目的的是( )

A . 装置甲:气体从a口进入,收集NH3
B . 装置乙:实验室测定中和热
C . 装置丙:实验室制取并收集乙酸乙酯
D . 装置丁:验证HCl气体易溶于水
实验室提供如图所示的仪器和高锰酸钾、石灰石、二氧化锰、稀硫酸、纯碱五种药品及火柴等相应物品:


-
(1) 写出利用上述仪器和药品,用化学方程式表示制取该气体的化学反应原理,在制取该气体的整个实验过程中需要用到的仪器有(填仪器序号);
-
(2) 如果下图用氯酸钾制氧气,请同学们将图补充完整;

-
(3) 上图中用此方法收集气体时.证明该气体已经收集满的现象是;
-
(4) 实验结束后要先后。
用如图所示装置进行下列实验,能达到实验目的的是( )
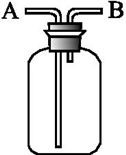
A . 瓶中盛适量浓硫酸,从A口进气来干燥NH3
B . 从B口进气,用排空气法收集SO2
C . 瓶中盛满水,从B口进气,用排水法收集NO2
D . 瓶中盛满水,A口连接导管并伸入量筒中,从B口进气用排水法测量生成NO的体积,
在烧瓶中加入铜片和稀硝酸以制取较纯净的一氧化氮,反应开始后发现烧瓶中充满红棕色气体,这时的操作应是( )
A . 立即接上收集容器,用向下排空气法收集
B . 立即用排空气法收集
C . 待烧瓶中红棕色气体消失后,用排水法收集
D . 待烧瓶中的红棕色气体消失后,用向上排空气法收集
常温常压下,下列气体能用瓶口向下排空气法收集的是( )
A . CO2
B . NH3
C . Cl2
D . SO2
实验是化学研究的基础,关于下列各实验装置的叙述中正确的是( )
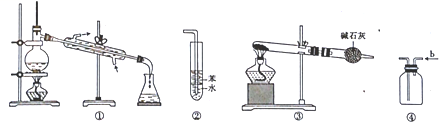
A . 装置①常用于分离互不相溶液体混合物
B . 装置②可用于吸收HCl气体,并防止倒吸
C . 以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D . 装置④b口进气,用排空气法可收集CO2、NO等气体
下列叙述不正确的是( )
A . NH3的喷泉实验说明氨气极易溶入水
B . NO和NH3均可用排空气法收集
C . 盛液溴的瓶加少量水防止液溴的挥发
D . NH3遇到挥发性强酸就能冒白烟
下列说法错误的是( )
A . 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B . 用排饱和氯化铵溶液的方法收集氨气
C . 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火
D . 在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色
下列实验装置能达到目的的是( )
A . 实验室制乙酸乙酯 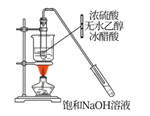 B . 比较Ksp( AgCl)和Ksp(AgI )的大小
B . 比较Ksp( AgCl)和Ksp(AgI )的大小 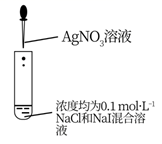 C . 制备并收集干燥的NH3
C . 制备并收集干燥的NH3 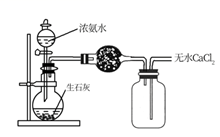 D . 制取和收集少量CO2、NO和O2
D . 制取和收集少量CO2、NO和O2 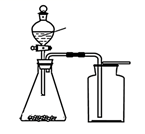
 B . 比较Ksp( AgCl)和Ksp(AgI )的大小
B . 比较Ksp( AgCl)和Ksp(AgI )的大小  C . 制备并收集干燥的NH3
C . 制备并收集干燥的NH3  D . 制取和收集少量CO2、NO和O2
D . 制取和收集少量CO2、NO和O2 
实验室制备下列气体所选试剂、制备装置及收集方法均正确的是( )
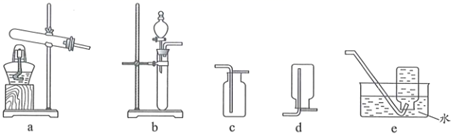
| 气体 | 试剂 | 制备装置 | 收集方法 | |
| A | | | b | e |
| B | | Cu和稀硫酸 | b | c |
| C | NO | Cu和稀硝酸 | b | c |
| D | | | a | d |
A . A
B . B
C . C
D . D
氮化钙 有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、新型陶瓷工业等领域。
有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、新型陶瓷工业等领域。 部分理化性质如下表:
部分理化性质如下表:
 有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、新型陶瓷工业等领域。
有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、新型陶瓷工业等领域。 部分理化性质如下表:
部分理化性质如下表:
|
性质 |
颜色、状态 |
熔点 |
特性 |
|
具体描述 |
常温下为棕色固体 |
1195 |
空气中会被氧化,遇水强烈水解,产生刺激性气味气体 |
工业上利用单质钙在氮气流中,控制温度450℃,可制得氮化钙。实验室模拟工业制备氮化钙,并对氮化钙纯度进行测定,实验方案如下:
-
(1) Ⅰ.
 制备:
制备:

A处产生
 , 请写出A中反应的化学方程式。工业上一般采用(填具体做法)制取
, 请写出A中反应的化学方程式。工业上一般采用(填具体做法)制取 。
。 -
(2) 装置的连接顺序为A→(注:以上所有装置都能用到)。
-
(3) 实验开始时,先启动A处反应,一段时间后再点燃B处酒精灯,其原因是。
-
(4) 制备过程中D处导管必须始终插入水中,目的是①便于观察
 的流速;②。
的流速;②。
-
(5) Ⅱ.
 纯度测定(已知
纯度测定(已知 摩尔质量为
摩尔质量为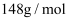 , 所含的杂质不与水反应,氨气极易溶于水,不溶于煤油。)
, 所含的杂质不与水反应,氨气极易溶于水,不溶于煤油。)
方案一:称取氮化钙样品2.4g,按图1所示装置进行实验,发现B装置增重0.51g。

该样品中氮化钙的质量分数为。
方案二:取与方案一同质量的样品,改用图2装置进行纯度测定,倾斜Y型管,将蒸馏水倒入样品管中,充分反应后测量气体体积。
方案二测得的氮化钙纯度为95%左右,试分析方案一测得的氮化钙纯度偏低的原因。
如图a、b、c表示相应仪器中加入的试剂,可用图中装置制取、净化、收集的气体是( )

编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 固体氢氧化钠 | 浓硫酸 |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
C | SO2 | 浓硫酸 | 固体亚硫酸钠 | 浓硫酸 |
D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
A . A
B . B
C . C
D . D
最近更新

 和浓盐酸
和浓盐酸

 和
和