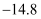过滤 知识点题库
A.过滤法 B.分液法
C.蒸馏法 D.结晶法
①分离水和豆油的混合物;
②从含有硝酸钾和少量氯化钾的混合溶液中获得硝酸钾;
③分离饱和食盐水和沙子的混合物;
④分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃),已知四氯化碳和甲苯互溶。
步骤一:铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入Na2CO3溶液,加热、过滤、洗涤、干燥、称量,质量记为m1。
步骤二:FeSO4的制备。将上述铁屑加入到一定量的稀硫酸中,充分反应后过滤并用少量热水洗涤锥形瓶和滤纸。滤液及洗涤液完全转移至蒸发皿中。滤渣干燥后称重,质量记为m2。
步骤三:硫酸亚铁铵的制备。准确称取所需质量的(NH4)2SO4加入“步骤二”中的蒸发皿中,缓缓加热一段时间后停止,冷却,待硫酸亚铁铵结晶后过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量。
步骤四:用比色法测定硫酸亚铁铵的纯度。
回答下列问题:
-
(1) 步骤三中称取的(NH4)2SO4质量为。
-
(2) ①铁屑用Na2CO3溶液处理的目的是。
制备FeSO4溶液时,用右图装置趁热过滤,原因是。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是。
③比色法测定硫酸亚铁铵纯度的实验步骤为:Fe3+标准色阶的配制、待测硫酸亚铁铵溶液的配制、比色测定。标准色阶和待测液配制时除均需加入少量稀盐酸外,还应注意的问题是。
④该实验最终通过确定硫酸亚铁铵产品等级。
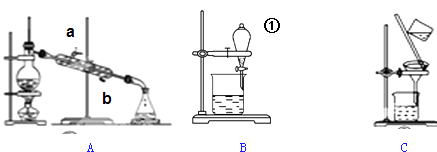
根据上图装置回答下列问题:
-
(1) 若用装置A分离CCl4和溴苯的混合物(已知CCl4和溴苯互溶,沸点分别为76.75℃和156.2℃),在实验时冷却水从冷凝管的(填“a”或“b”)端通入;温度计读数为80℃时,锥形瓶中收集到的物质是.
-
(2) 装置B中仪器①的名称是,用装置B分离混合物时,为使液体顺利流下,应进行的操作是.
-
(3) 粗盐中含有少量泥沙、MgCl2、CaCl2及硫酸盐,将粗盐溶解后,先用装置C将泥沙除去,除去泥沙后还需进一步提纯,粗盐提纯步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl3溶液;③加入过量的NaOH溶液;④调节溶液PH等于7;⑤溶解;⑥过滤;⑦蒸发.正确的操作顺序是 .A . ⑤②③①⑥④⑦ B . ⑤①②③⑥④⑦ C . ②①③④⑥⑦ D . ⑤③②①⑥④⑦
 B . 除去氯化钠晶体中混有的I2晶体:
B . 除去氯化钠晶体中混有的I2晶体:  C . 分离CCl4中的Br2:
C . 分离CCl4中的Br2:  D . 除去CO2气体中的HCl气体:
D . 除去CO2气体中的HCl气体: 
| 选项 | 物质 | 杂质 | 试剂 | 主要操作 |
| A | K2CO3 | KHCO3 | 无 | 加热 |
| B | CuO | Al2O3 | 氨水 | 过滤 |
| C | I2 | H2O | 乙醇 | 萃取 |
| D | CO2 | HCl | 饱和Na2CO3溶液 | 洗气 |
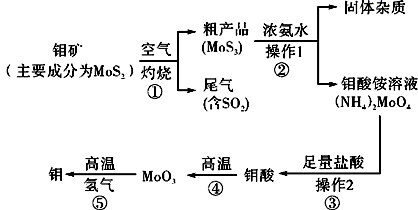
-
(1) 反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂:。
-
(2) 如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有:。
-
(3) 钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为。
-
(4) 工业上制备还原性气体CO和H2的反应原理为CO2+CH4
 2CO+2H2 , CH4+H2O
2CO+2H2 , CH4+H2O  CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
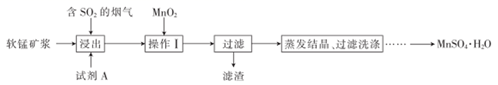
已知:浸出液中的金属离子主要是Mn2+ , 还含有少量的Fe2+。回答下列问题:
-
(1) 实验室进行过滤操作时用到的玻璃仪器有玻璃棒、。
-
(2) 浸出后,锰主要以Mn2+的形式存在,写出相应反应的离子方程式:。
-
(3) 浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。欲消除生成的硫酸,可选用的试剂A是________(填字母)。A . MnCO3 B . MnO2 C . Mn(OH)2 D . MnSO4
-
(4) 操作I的目的是和调节溶液的pH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是。
-
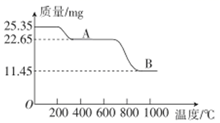
(5) 通过煅烧MnSO4·H2O可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余固体质量变化的曲线如图所示。根据图中数据可得MnxO4中x的值为。A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,则该过程中发生反应的化学方程式:。
| 选项 | 实例 | 分离方法 |
| A | 除去氯化钠溶液中的泥沙 | 过滤 |
| B | 用乙醚提取青蒿中的青蒿素 | 萃取 |
| C | 分离乙酸(沸点为118摄氏)与乙醚(沸点为34摄氏度) | 蒸馏 |
| D | 分离汽油和水的混合物 | 结晶 |
 B . 过滤
B . 过滤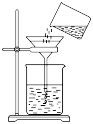 C . 将剩余钠放回试剂瓶
C . 将剩余钠放回试剂瓶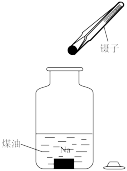 D . 转移溶液
D . 转移溶液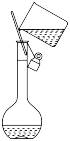
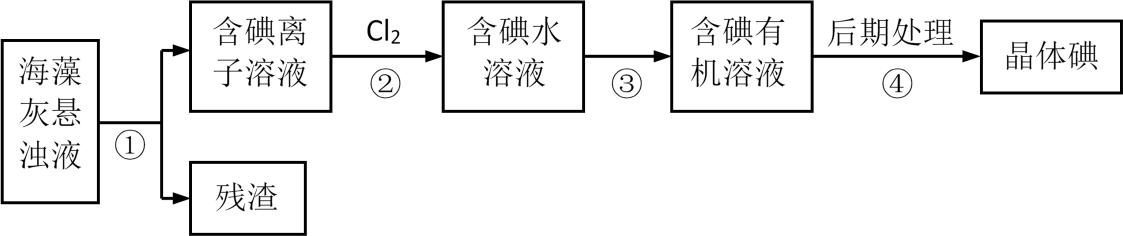
下列判断不正确的是( )
 是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示:
是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示: | 物质 | 化学式 | 相对分子质量 | 熔点/ | 沸点/ | 相对密度 | 溶解性 |
| 苯硫酚 | | 110 | | 169.5 | 1.07 | 难溶于水 |
| 苯磺酰氯 | | 176.5 | 14.5 | 251 | 1.38 | 难溶于水 |
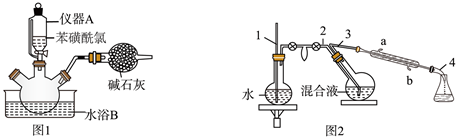
操作步骤:
①向三口烧瓶中加入 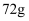 冰和
冰和 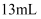 浓硫酸。
浓硫酸。
②再向三口烧瓶中慢慢加入 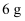 苯磺酰氯,尽快地分次加入
苯磺酰氯,尽快地分次加入 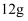 锌粉,继续反应
锌粉,继续反应 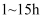 ,温度保持在
,温度保持在 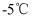 左右,如图1。
左右,如图1。
③撤去水浴B,微热三口烧瓶,并保持一定的回流。反应平稳后,再加热 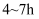 。
。
④将反应后的混合液进行水蒸气蒸馏,分出苯硫酚,如图2。
⑤加入氯化钙,经操作X得粗品 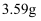 。再进行蒸馏,收集馏分,得纯品
。再进行蒸馏,收集馏分,得纯品 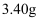 。
。
回答下列问题:
-
(1) 仪器A的名称是。
-
(2) 已知:在水中加入盐,水的沸点会升高,凝固点会降低。水浴B应选择(填标号)。
a.冰盐水浴 b.冷水浴 c.热水浴
-
(3) 在水蒸气蒸馏中(如图2),导管1的作用是,冷凝管中冷却水从(填“a”或“b”,下同)口进、口出。
-
(4) 步骤⑤中操作X是。蒸馏时,收集馏分时温度计的读数为
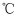 。
。
-
(5) 本实验中,苯硫酚的产率约为(保留整数)
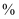 。
。
-
(6) 取少量苯硫酚产品于酸性
 溶液中,振荡,溶液褪色,说明苯硫酚具有(填“氧化”或“还原”)性。
溶液中,振荡,溶液褪色,说明苯硫酚具有(填“氧化”或“还原”)性。

-
(1) ①“溶浸”时提高溶浸率的措施有(任写一个)。
②“溶浸”后的锡主要以SnCl4的形式存在于混合液中。写出Sn与SnCl4反应的化学方程。
③“溶浸”时,加热反应器使反应液温度升高至60℃,开始通入Cl2 , 随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80~90℃之间,不宜过高。温度不宜过高的原因是。“操作a”的名称是。
-
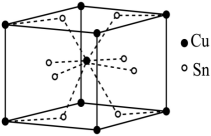
(2) ①基态Sn原子价层电子的电子排布式为,在元素周期表中属于区。
②铜锡合金晶体有多种结构,其中一种晶体的晶胞为立方晶胞(如图),则该晶体中铜、锡原子个数比为,若阿伏加德罗常数为NA , 晶胞参数为apm,则合金晶体的密度为g•cm-3(用含a、NA的式子表示,不必化简)。