洗气 知识点题库
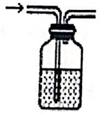
下面关于下图所示实验装置的使用方法中叙述正确的是( )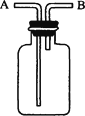
①用于排水集气:充满水,B进气,A排放水
②用于收集密度比空气大的气体:B进气,A排放空气
③用于收集密度比空气小的气体:B进气,A排放空气
④用于洗气:装入洗液,A进气,B出气

(1)浓硫酸所属的物质类型是 .(填序号)①非金属氧化物 ②化合物 ③酸 ④混合物
(2)碱石灰为什么可以用作干燥剂? .(答2点理由)
(3)用生石灰干燥剂的食品包装袋上应该标示的是 .(填序号)
①请勿食用 ②可以食用③生产日期④含生石灰⑤如果不小心进入眼睛内,请迅速用水冲洗或找医生.
下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是( )
X | Y | Z | |
A | NO2 | SO2 | BaCl2 |
B | NH3 | O2 | Al2(SO4)3 |
C | NH3 | CO2 | NaCl(饱和) |
D | CO | O2 | Ca(OH)2 |


-
(1) 实验中要保证Cu丝始终保持红热,其中发生的化学反应可表示为:,2NH3 + 3CuO
 N2 + 3Cu + 3H2O。倘若在实验中观察到铜丝变黑,可采用的措施是,在此反应过程中铜丝的作用是和;浓硫酸的作用是吸收多余的氨气和。
N2 + 3Cu + 3H2O。倘若在实验中观察到铜丝变黑,可采用的措施是,在此反应过程中铜丝的作用是和;浓硫酸的作用是吸收多余的氨气和。
-
(2) 当通过的气体为纯氧时,测得气体的密度为ρ1。
在空气的净化过程中,为除去可能混有的H2S、CO2和水蒸气,可将气体先通过,当净化后的空气通过上述反应系统,在这种情况下测得最终密度ρ2=1.256g·L-1。
-
(3) 当空气直接通过灼热的Cu网,测得气体的密度为ρ3。试ρ1、ρ2、ρ3比较的大小:。
 B . 过滤
B . 过滤  C . 加热蒸发
C . 加热蒸发  D . 分液
D . 分液 

-
(1) 实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,检查气密性
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③关闭活塞K1、K2 , 打开K3 , 缓缓鼓入空气数分钟,目的是。
④关闭活塞K1、K2 , 打开K3 , 点燃酒精灯加热至不再产生气体。装置B中发生了能使装置D质量增加的化学方程式为。
⑤打开活塞K1 , 缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
-
(2) 关于该实验方案,请回答下列问题。
①E处干燥管中盛放的药品是,如果实验中没有该装置,则可能导致测量结果NaHCO3的质量分数(填“偏大”“偏小”或“无影响”)。
②有同学认为采用滴定法可以测得其中NaHCO3的质量分数,因此提出了以下方案:
准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴至终点,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴至终点,所用HCl溶液体积为V2mL。写出该样品中NaHCO3质量分数的计算式:NaHCO3(%)=。
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。

回答下列问题:
-
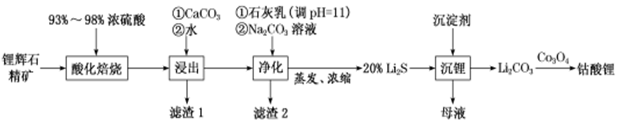
(1) 为提高“酸化焙烧”效率,常采取的措施是(答一条即可)。
-
(2) 向“浸出液”中加入CaCO3 , 其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、Al3+完全沉淀,则pH至少为(保留2位有效数值)。(已知:完全沉淀后离子浓度低于1×10-5 mol/L)
-
(3) “滤渣2”的主要化学成分为 。
-
(4) “沉锂”过程中加入的沉淀剂为饱和的 (化学式)溶液;该过程所获得的“母液”中仍含有大量的Li+ , 可将其加入到“ ”步骤中。
-
(5) Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为。
| 选项 | 气体(杂质) | 广口瓶内的试剂 | 洗气装置 |
| A | Cl2 (HCl) | 饱和NaCl溶液 | |
| B | C2H4 (CO2) | NaOH溶液 | |
| C | C2H6 (C2H4 ) | 酸性KMnO4溶液 | |
| D | CO2 (SO2) | 饱和NaHCO3溶液 |
-
(1) 甲组同学设计下列装置用干燥纯净的氯气制备实验原料漂白粉[已知:3Ca(ClO)2
 Ca(ClO3)2+2CaCl2△H>0]。
Ca(ClO3)2+2CaCl2△H>0]。 
①各仪器接口连接顺序为(气流自左至右,用小写字母表示)。
②装置B中发生反应的离子方程式为 。
③装置A用冰水冷却的目的是。
-
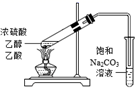
(2) 乙组同学用甲组制得的漂白粉与乙醇溶液反应制备氯仿的实验装置如图。

①装置I需控制温度约为70℃,适宜的加热方式是 ,温度不宜过高,其目的是。
②装置Ⅱ的名称是。
③一定条件下,装置I中漂白粉先与乙醇溶液反应生成Cl2和Ca(OH)2 , 然后Cl2与CH3CH2OH反应生成CCl3CHO,CCl3CHO再与Ca(OH)2反应生成CHCl3和一种盐,CCl3CHO与Ca(OH)2反应的化学方程式为 。
-
(3) 丙组同学用下列方法对乙组制得的粗产品进行提纯。已知浓硫酸能与乙醇混溶。
步骤I.向粗产品中加入适量浓硫酸,搅拌至呈淡咖啡色,分液得有机层;
步骤Ⅱ.用15%的Na2CO3溶液洗涤多次,分液得有机层;
步骤Ⅲ.向有机层中加入少量无水CaCl2。
步骤I中用浓硫酸洗涤的目的是;步骤Ⅱ中证明已洗涤干净的依据是;步骤Ⅲ中加入少量无水CaCl2的目的是 。
| | | | |
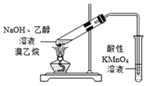
| A.制备并收集乙酸乙酯 | B.验证溴乙烷的消去产物是乙烯 | C.实验室制乙炔 | D.除去甲烷中的乙烯 |
 B . 检验K2CO3中的K+
B . 检验K2CO3中的K+  C . 稀释浓硫酸
C . 稀释浓硫酸  D . 定容
D . 定容 
| 选项 | 被提纯的物质 | 除杂试剂及分离方法 |
| A | Na2CO3溶液(NaHCO3) | 过量的澄清石灰水,过滤 |
| B | Fe2O3(SiO2) | 加入过量NaOH溶液后过滤、洗涤 |
| C | 乙烷(乙烯) | 将混合气体通入盛有酸性KMnO4溶液的洗气瓶 |
| D | 乙烷(乙烯) | 通入足量H2 , 在催化剂作用下充分反应 |