镁、铝的重要化合物 知识点题库
I.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2 .
-
(1) 该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式为 ;
II.已知:Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H1=﹣441kJ•mol﹣1
H2O(g)=H2(g)+
 O2(g)△H2=242kJ•mol﹣1
O2(g)△H2=242kJ•mol﹣1Mg(s)+
 O2(g)=MgO(s)△H3=﹣602kJ•mol﹣1
O2(g)=MgO(s)△H3=﹣602kJ•mol﹣1 -
(2)
氢氧化镁分解的热化学方程式为 ;
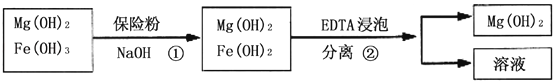
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁.
-
(3) 步骤①中每消耗0.1mol保险粉(Na2S2O4)转移0.6mol e﹣ , 则此反应的离子方程式为 ;
-
(4) 已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应.虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2 . 请从沉淀溶解平衡的角度加以解释 ;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
序号
精制阻燃剂的条件
阻燃剂铁含量
提纯体系温度/℃
加入EDTA质量/g
加入保险粉质量/g
W(Fe)/(10﹣4g)
1
40
0.05
0.05
7.63
2
40
0.05
0.10
6.83
3
60
0.05
0.10
6.83
4
60
0.10
0.10
6.51
-
(5) 若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是 (填字母).
①40℃②60℃③EDTA质量为0.05g ④EDTA质量为0.10g⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤B.②④⑥C.①④⑥D.②③⑤
 B .
B .  C .
C . 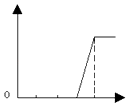 D .
D . 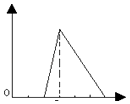
①钠与水反应生成NaOH和H2 , 所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈,性质更活泼的铝不能稳定存在于空气中
③Cu(OH)2受热易分解,Fe(OH)3受热也易分解
④Al(OH)3能与NaOH反应,Be(OH)2也能与NaOH反应.
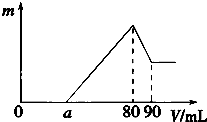
-
(1) )80~90mL对应反应的离子方程式.
-
(2) 金属铝的质量为
-
(3) 盐酸的体积是mL.
-
(4) a的取值范围是.
-
(5) n(Mg)/n(Al)的最大值是.
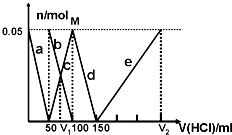
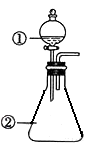
选项
①中物质
②中物质
预测②中的现象
-
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为;明矾可净水是因为在天然水中生成胶状Al(OH)3 , Al(OH)3具有的作用。
-
(2) 碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3 , 还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:

①盐酸溶解铝土矿过程中,发生反应的离子方程式为、;溶解过程中需不断搅拌,目的是。
②加适量铝粉的主要作用是。
③蒸发浓缩所需玻璃仪器为。
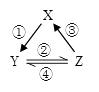
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
|
X |
Y |
Z |
|
|
① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
|
② |
Na2O2 |
Na2CO3 |
NaHCO3 |
|
③ |
KOH溶液 |
Al |
稀盐酸 |
-
(1) 同组物质中,Y既能与X发生氧化还原反应,又能与Z发生氧化还原反应的是(填数字符号)。若Y与X或Z完全反应,产生的气体在标准状况下的体积为 67.2L,则转移电子的数目为。
-
(2) 写出第①组X与Y反应的离子方程式。
-
(3) 第②组固体X可作供氧剂,写出其中与二氧化碳的化学反应方程式。
 NO2
B . Fe(OH)2
NO2
B . Fe(OH)2  Fe(OH)3
C . S
Fe(OH)3
C . S  SO3
D . Al2O3
SO3
D . Al2O3  Al(OH)3
Al(OH)3
 具有强氧化性,可用于自来水的杀菌消毒
B .
具有强氧化性,可用于自来水的杀菌消毒
B .  熔点高,可用于电解冶炼铝的原料
C .
熔点高,可用于电解冶炼铝的原料
C .  硬度大,可用于制造光导纤维
D .
硬度大,可用于制造光导纤维
D .  易溶于水,可用于作制冷剂
易溶于水,可用于作制冷剂