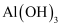镁、铝的重要化合物 知识点题库
下列物质性质与应用对应关系正确的是( )
A . 晶体硅熔点高硬度大,可用于制作半导体材料
B . 氢氧化铝胶体具有吸附性,可用于制胃酸中和剂
C . 人缺碘就会引起碘缺乏病,我国大部分地区都缺碘,因此80年代国家强制给食用盐中加入碘单质
D . 硅胶具有吸水性,在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮
下列各操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向石灰水中通入过量的CO2
②向Ca(ClO)2溶液中通入过量SO2
③向氢氧化铝胶体中逐滴滴入过量稀NaOH溶液
④向氯化钡溶液中逐渐通入过量二氧化碳
⑤向AgNO3溶液中逐滴滴入过量稀氨水
⑥向饱和碳酸钠溶液中逐渐通入过量二氧化碳.
A . ①②⑥
B . ①③⑤
C . ②④⑥
D . ③④⑤
在下列各物质中,加入过量盐酸后,最终不产生沉淀或浑浊的是( )
A . 偏铝酸钠溶液
B . 苯酚钠溶液
C . 硅酸钠溶液
D . 硫代硫酸钠溶液
下列有关Al(OH)3的图象不正确的是( )
A .  向AlCl3溶液中滴加NaOH溶液
B .
向AlCl3溶液中滴加NaOH溶液
B .  向NaOH溶液中滴加AlCl3溶液
C .
向NaOH溶液中滴加AlCl3溶液
C .  向Na[Al(OH)4]溶液中通入CO2
D .
向Na[Al(OH)4]溶液中通入CO2
D .  向AlCl3溶液中滴氨水
向AlCl3溶液中滴氨水
 向AlCl3溶液中滴加NaOH溶液
B .
向AlCl3溶液中滴加NaOH溶液
B .  向NaOH溶液中滴加AlCl3溶液
C .
向NaOH溶液中滴加AlCl3溶液
C .  向Na[Al(OH)4]溶液中通入CO2
D .
向Na[Al(OH)4]溶液中通入CO2
D .  向AlCl3溶液中滴氨水
向AlCl3溶液中滴氨水
A、B、C、D都是核外电子总数为10的微粒。
-
(1) A为中性微粒。如果A能刻蚀玻璃,则A是(填化学式,下同);如果A的水溶液显碱性,则A是。
-
(2) B是带电微粒。如果B为阳离子且其水溶液能使紫色石蕊溶液变红,则B是;如果B为阴离子且其水溶液能使无色酚酞溶液变红,则B是。
-
(3) 若1个C微粒中含有5个原子,带正电荷,遇碱放出NH3 , 则C是。
-
(4) 若D微粒遇阴离子B,先生成沉淀,后沉淀溶解,则D是。
下列物质可用于治疗胃酸过多的是( )
A . 碳酸氢钠
B . 氢氧化铝
C . 氢氧化钠
D . 硫酸钡
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
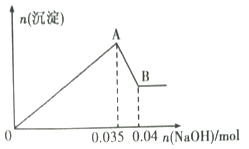
根据上述实验和图中数据:
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。

根据上述实验和图中数据:
-
(1) 该废水中一定不含有的离子有(填离子符号);
-
(2) 写出A→B 过程中发生反应的离子方程式:;
-
(3) 该废水中,c(Al3+)=;
-
(4) ①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
如图是工业制取菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程

请回答有关问题:
-
(1) 菱镁矿进入酸浸池前需要粉碎,目的是 。
-
(2) 氧化池通入Cl2的目的是氧化 (填化学式),工业上不选用硝酸做氧化剂的原因是和。
-
(3) 物质甲可以是_____________A . MgO B . Mg(OH)2 C . NaOH溶液 D . 稀氨水
-
(4) 由MgCl2溶液制取无水MgCl2的操作方法 。
-
(5) 当Fe3+完全沉淀时,求最小pH。已知:氢氧化铁ksp=1.0×10-38 , 离子浓度小于1×10-5 mol/L认为沉淀完全
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3 , 在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
-
(1) I、II、III、IV四步操作采取的分离方法是。
-
(2) 根据上述框图反应关系,写出下列B、C、E所含物质的化学式
沉淀固体B;C;E
-
(3) 写出①、④四个反应方程式(是离子反应的写离子方程式)
① ④
既能与盐酸反应又能与氢氧化钠溶液反应的物质是( )
A . Cu
B . Fe2O3
C . AlCl3
D . Al
既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①SiO2 ②Al ③NaHCO3 ④Al2O3 ⑤(NH4)2CO3
A . 全部
B . ②④⑤
C . ②③④⑤
D . ①②③④
下列各组物质的转化中,一定条件下均能一步实现的组合是( )

A . ①②④
B . ①②③
C . ②③④
D . ③④⑤
下列实验过程中沉淀的物质的量(Y)与加入的试剂的量(X)之间的关系正确的是:( )

A . 如图A:向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B . 如图B:向NaAlO2溶液中滴加盐酸且边滴边振荡
C . 如图C:向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D . 如图D:向等物质的量的NaOH、Ba(OH)2混合溶液中逐渐通入二氧化碳至过量
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
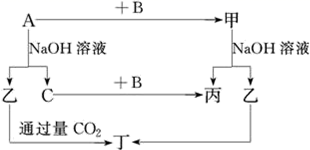
根据图示转化关系回答:
-
(1) 写出下列物质的化学式。
A,B,乙,丁。
-
(2) 写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式。
②甲与NaOH溶液反应的离子方程式。
下列关于铝及其化合物的说法错误的是( )
A . Al 既可用于食品包装,也可用做建筑材料
B . Al2O3既可用来冶炼金属Al,也可用做耐火材料
C . 明矾[KAl(SO4)2⋅12H2O]既可用做净水剂,也可用作消毒剂
D . Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐
在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A . S  SO3
SO3  H2SO4
B . Cu2(OH)2CO3
H2SO4
B . Cu2(OH)2CO3  CuSO4(aq)
CuSO4(aq)  Cu
C . SiO2
Cu
C . SiO2  Si
Si  SiCl4
SiCl4  Si
D . Mg(OH)2
Si
D . Mg(OH)2  MgCl2(aq)
MgCl2(aq)  Mg
Mg
 SO3
SO3  H2SO4
B . Cu2(OH)2CO3
H2SO4
B . Cu2(OH)2CO3  CuSO4(aq)
CuSO4(aq)  Cu
C . SiO2
Cu
C . SiO2  Si
Si  SiCl4
SiCl4  Si
D . Mg(OH)2
Si
D . Mg(OH)2  MgCl2(aq)
MgCl2(aq)  Mg
Mg
下图是元素周期表的一部分,针对表中①~⑧元素,填写下列空白:

-
(1) 元素⑦在周期表中的位置可表示为第周期第族。
-
(2) 图中8种元素最高价氧化物对应的水化物中,酸性最强的是(填化学式,下同),碱性最强的是。
-
(3) 写出由①③元素构成的化合物对应的电子式。(写一种即可)
-
(4) 元素周期表中位于斜对角线的两种元素的化学性质十分相似,称之为“对角线规则”。如金属Be与金属Al的单质及其化合物性质相似。
①写出证明Al2O3是两性氧化物的化学反应的离子方程式:,。
②Be(OH)2和Mg(OH)2可用试剂鉴别。
能符合题意表示下列反应的离子方程式的是( )
A . 往FeI2溶液中通入少量 B . 将水垢浸泡在醋酸中
B . 将水垢浸泡在醋酸中 C . NaOH溶液与过量Ca(HCO3)2溶液反应
C . NaOH溶液与过量Ca(HCO3)2溶液反应 D . 向NaAlO2溶液中通入过量
D . 向NaAlO2溶液中通入过量
 B . 将水垢浸泡在醋酸中
B . 将水垢浸泡在醋酸中 C . NaOH溶液与过量Ca(HCO3)2溶液反应
C . NaOH溶液与过量Ca(HCO3)2溶液反应 D . 向NaAlO2溶液中通入过量
D . 向NaAlO2溶液中通入过量
化学创造美好生活。下列物质性质与用途的对应关系错误的是( )
选项 | 物质性质 | 物质用途 |
A | 小苏打能与碱反应 | 可用作抗酸药 |
B |
| 可用作耐高温材料 |
C |
| 可用作呼吸面具供氧剂 |
D | 漂白粉具有强氧化性 | 可用于生活用水的消毒 |
A . A
B . B
C . C
D . D
下列物质之间通过一步反应不能实现如图所示转化的是( )

选项 | 甲 | 乙 | 丙 |
A | C | CO |
|
B |
|
|
|
C | Si |
|
|
D | Na | NaOH | NaCl |
A . A
B . B
C . C
D . D
最近更新
 熔点高
熔点高 能吸收
能吸收 产生
产生