工业制取硫酸 知识点题库
下列说法正确的是( )
A . 联合制碱法的优点是减少了对设备的腐蚀
B . 工业生产硫酸时,用98%硫酸的来吸收三氧化硫,可以避免形成酸雾并提高吸收率
C . 合成氨是天然固氮的方法之一
D . 碳酸钠俗称小苏打,甲烷是一种清洁能源
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2 , 可制取Na2S2O3 , 同时放出CO2。在该反应中( )
A . 硫元素既被氧化又被还原
B . 氧化剂与还原剂的物质的量之比为1:2
C . 每生成1molNa2S2O3 , 转移4mol电子
D . 相同条件下,每吸收10m3SO2就会放出2.5m3CO2
下列关于化工生产原理的叙述中,符合目前工业生产实际的是( )
A . 氯碱工业中,离子交换膜的作用是防止离子运动
B . 硫酸、硝酸、合成氨均使用了催化剂
C . 石油裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃
D . 氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸
在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因两者都是正确的是( )
A . 硫铁矿燃烧前粉碎得越细越好,因为大块的硫铁矿燃烧不完全
B . 从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
C . SO2氧化为SO3时需使用Fe做催化剂,这样可以无需加热
D . 用98.3%的硫酸吸收SO3 , 目的是为了防止形成酸雾,以便使SO3吸收完全
在H2SO4、HNO3、NH3的工业生产中,具有的共同点是( )
A . 使用H2作原料
B . 使用催化剂
C . 使用吸收塔设备
D . 使用尾气吸收装置
【化学选修2:化学与技术】

-
(1) 火山喷发所产生的硫磺可用于生产重要的化工原料硫酸.某企业用右图所示的工艺流程生产硫酸:
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装(填设备名称).吸收塔中填充有许多瓷管,其作用是.
②为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%.为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为.假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为.(空气中氧气的体积分数按0.2计),该尾气的处理方法是.
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是(可多选).
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
-
(2) 硫酸的用途非常广泛,可应用于下列哪些方面 (可多选).A . 橡胶的硫化 B . 表面活性剂“烷基苯磺酸钠”的合成 C . 铅蓄电池的生产 D . 过磷酸钙的制备
-
(3) 矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式.
下列有关工业生产的叙述中错误的是( )
A . 电解氯化钠溶液制金属钠
B . 石灰石是炼铁和制玻璃的原料之一
C . 氯气通入石灰乳中制漂白粉
D . 硫酸工业的主要设备有沸腾炉、接触室、吸收塔
下列有关硫及其化合物的说法中正确的是( )
A . 浓硫酸具有吸水性,可做干燥剂,不能干燥 NH3,也不能干燥 H2S 等还原性气体
B . 浓硫酸与灼热的炭反应,体现了浓硫酸的强氧化性和酸性
C . SO2 和 Cl2 均可使品红溶液褪色,但将溶有 SO2 的品红溶液加热后又恢复红色,说明 SO2 的氧化性没有 Cl2 强
D . 以 FeS2 为原料生产硫酸过程中,要用到沸腾炉、接触室、吸收塔等设备,所涉及的反应均为氧化还原反应
工业制硫酸和合成氨生产中相同的是( )
A . 所有原料气都循环使用
B . 都用压缩机压缩原料气
C . 用了完全相同的催化剂
D . 都用热交换器进行加热
硫酸工业中,接触室发生催化氧化(2SO2+O2 ⇌ 2SO3) 的装置如右图,下列说法正确的是( )

A . a处进入的气体中SO2过量
B . 气体的温度a处>b处
C . a、b、c三处气体成分相同
D . d处出来的气体只含SO3
下列说法正确的是( )
A . 冶铝工业中,采用铁作阳极,碳作阴极
B . 硫酸工业中,采用低温条件来提高SO2的转化率
C . 合成氨工业中,将氨气液化分离来增大正反应速率
D . 氯碱工业中,采用阳离子交换膜防止OH-与阳极产物Cl2反应
下列有关工业生产中,错误的是( )
A . 制氯气:电解饱和食盐水
B . 硫酸工业:在接触室中SO2氧化为SO3
C . 炼铁:用CO在高温下还原铁矿石中的铁
D . 制钛:钠从四氯化钛水溶液中置换出钛
工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g)  Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g) 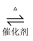 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
-
(1) Ⅰ.反应①配平后各物质系数分别为、、、。若每生成1molSO2时反应放热426.5kJ,则ΔH1=。
-
(2) 工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是。
-
(3) Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
0.1Mp
0.5Mp
1Mp
10Mp
400℃
99.2
99.6
99.7
99.9
500℃
93.5
96.9
97.8
99.3
600℃
73.7
85.8
89.5
96.4
反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是。
-
(4) 若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为。
-
(5) Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
Na2SO3溶液吸收SO2的离子方程式为 ;
-
(6) 常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)A . c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-) B . c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3) C . c(Na+)>c(SO32-)>c(OH-)>c(H+) D . 水电离出c(OH-)=1×10-8 mol·L-1
下列关于工业制硫酸和硝酸的说法错误的是( )
A . 工业制硝酸是将NO2溶于水,同时通入氧气以提高转化率,减少尾气排放
B . 工业制硫酸会产生SO2和SO3尾气
C . 工业制硫酸应对SO2进行循环利用
D . 工业制硝酸和硫酸排放的尾气是造成酸雨的主要原因
采用循环操作可以提高原料的利用率,下列工业生产中,没有采用循环操作的是( )
A . 氯碱工业
B . 硫酸工业
C . 硝酸工业
D . 合成氨工业
在合成氨、硫酸、纯碱的工业生产流程中,具有的共同点是( )
A . 原料气循环使用
B . 使用热交换器
C . 原料气净化
D . 加热
非金属及其化合物是一类重要的化工原料。回答下列问题:
-
(1) 向21.6g铁粉和铜粉的混合物中加入1L1mol/L硝酸溶液,充分反应,放出NO气体且金属有剩余。则反应后溶液中
 可能为。
可能为。
-
(2) 某化学兴趣小组为了探究
 、
、  同时通入
同时通入  中发生的反应,设计了如图所示的实验装置。
中发生的反应,设计了如图所示的实验装置。 
该化学兴趣小组的同学为制取
 、
、  气体,现采用
气体,现采用  与70%的硫酸为原料制取
与70%的硫酸为原料制取  ,采用
,采用  和浓盐酸(12mol/L)为原料制取
和浓盐酸(12mol/L)为原料制取  。发生装置A应选择以下三种装置中的(填序号)。装置A中发生反应的化学方程式为。D装置中主要反应的离子方程式为。
。发生装置A应选择以下三种装置中的(填序号)。装置A中发生反应的化学方程式为。D装置中主要反应的离子方程式为。
-
(3)
 和
和  具有相似的化学性质,能使酸性
具有相似的化学性质,能使酸性  溶液褪色,反应的离子方程式为。
溶液褪色,反应的离子方程式为。 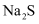 也能使酸性
也能使酸性  溶液褪色且溶液仍澄清,反应的离子方程式为。
溶液褪色且溶液仍澄清,反应的离子方程式为。
-
(4)
 用于工业制硫酸时,涉及反应的化学方程式是。
用于工业制硫酸时,涉及反应的化学方程式是。
下列说法错误的是( )
A . 硝酸可用于制造TNT、硝化甘油和硝化纤维
B . 甲醛俗称蚁醛、福尔马林,可用于制造酚醛树脂
C .  具有强氧化性,能与乙醇反应,得到绿色的
具有强氧化性,能与乙醇反应,得到绿色的 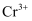 ,因此可用
,因此可用  测酒驾
D . 我国古代采用加热胆矾或绿矾的方法制取硫酸
测酒驾
D . 我国古代采用加热胆矾或绿矾的方法制取硫酸
 具有强氧化性,能与乙醇反应,得到绿色的
具有强氧化性,能与乙醇反应,得到绿色的 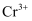 ,因此可用
,因此可用  测酒驾
D . 我国古代采用加热胆矾或绿矾的方法制取硫酸
测酒驾
D . 我国古代采用加热胆矾或绿矾的方法制取硫酸
二氧化硫是一种应用广泛的化工原料。在接触法制硫酸的工业中,二氧化硫制取三氧化硫的反应为2SO2(g)+O2(g) = 2SO3(g) ∆H= -196 kJ•mol-1.实验室用亚硫酸钠固体与70%的硫酸制取少量的二氧化硫。下列有关用二氧化硫制取三氧化硫的说法正确的是( )
A . 反应的∆S > 0
B . 2 mol SO2与足量O2反应,放出的热量为196 kJ
C . 工业上用通入足量的空气来提高SO2的转化率
D . 反应中每消耗1 mol SO2转移的电子数目约等于4×6.02×1023
 是制备硫酸的重要反应。下列叙述错误的是( )
是制备硫酸的重要反应。下列叙述错误的是( )
A . 催化剂 不改变该反应的逆反应速率
B . 使用催化剂改变活化能,但不改变反应热
C . 该反应是放热反应,升高温度能缩短反应达到平衡的时间
D . 恒温、恒压条件下,充入
不改变该反应的逆反应速率
B . 使用催化剂改变活化能,但不改变反应热
C . 该反应是放热反应,升高温度能缩短反应达到平衡的时间
D . 恒温、恒压条件下,充入 , 化学反应速率减慢,平衡逆向移动
, 化学反应速率减慢,平衡逆向移动
 不改变该反应的逆反应速率
B . 使用催化剂改变活化能,但不改变反应热
C . 该反应是放热反应,升高温度能缩短反应达到平衡的时间
D . 恒温、恒压条件下,充入
不改变该反应的逆反应速率
B . 使用催化剂改变活化能,但不改变反应热
C . 该反应是放热反应,升高温度能缩短反应达到平衡的时间
D . 恒温、恒压条件下,充入 , 化学反应速率减慢,平衡逆向移动
, 化学反应速率减慢,平衡逆向移动
最近更新



