浓硫酸的性质 知识点题库
一定量的浓硫酸与过量的镁充分反应,生成的气体是( )
A . SO2、 H2
B . SO2
C . H2
D . 无法确定
化学与日常生活密切相关,下列说法错误的是( )
A . 碘酒是指单质碘的乙醇溶液
B . 84消毒液的有效成分是NaClO
C . 浓硫酸可刻蚀石英制艺术品
D . 装饰材料释放的甲醛会造成污染
下列反应中,浓硫酸既表现出强氧化性又表现出酸性的是( )
A . 2NaCl+H2SO4(浓)  Na2SO4+2HCl↑
B . Na2SO3+H2SO4(浓)
Na2SO4+2HCl↑
B . Na2SO3+H2SO4(浓)  Na2SO4+SO2↑+H2O
C . C+2H2SO4(浓)
Na2SO4+SO2↑+H2O
C . C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O
D . 2FeO+4H2SO4(浓)
CO2↑+2SO2↑+2H2O
D . 2FeO+4H2SO4(浓)  Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
 Na2SO4+2HCl↑
B . Na2SO3+H2SO4(浓)
Na2SO4+2HCl↑
B . Na2SO3+H2SO4(浓)  Na2SO4+SO2↑+H2O
C . C+2H2SO4(浓)
Na2SO4+SO2↑+H2O
C . C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O
D . 2FeO+4H2SO4(浓)
CO2↑+2SO2↑+2H2O
D . 2FeO+4H2SO4(浓)  Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
下列叙述正确的是( )
A . 浓硫酸具有强氧化性,稀硫酸无氧化性
B . 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C . 浓硫酸在常温下能够使铁、铝形成氧化膜而钝化
D . 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
下列关于硫酸的叙述中,正确的是( )
A . 浓硫酸具有脱水性,因而能使蔗糖炭化
B . 浓硫酸有强氧化性,不可贮存在铝、铁容器中
C . 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D . 稀释浓硫酸时,应将水沿着器壁慢慢加入到浓硫酸中,并用玻璃棒不断搅拌
下列说法正确的是( )
A . 焦炭炼铁、发酵粉烘焙糕点均会产生温室气体
B . 浓硫酸滴在白纸上,白纸变黑,体现了浓硫酸的吸水性
C . Cu与H2SO4在加热条件下发生反应,体现了浓H2SO4的还原性
D . 雨水样品在空气中放置2小时后,测得pH变小,因为样品吸收了空气中的CO2
对于下列事实的解释错误的是 ( )
A . 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B . 浓硫酸能够干燥氯气、氢气等气体,说明浓硫酸具有吸水性
C . 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D . 氨水可使酚酞试剂变为红色,说明氨水显碱性
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A . 常温下,56 g铁片投入足量浓H2SO4溶液中生成NA个SO2分子
B . 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C . 50℃时,1.0 L pH=1的H2SO4 溶液中含有的H+数目为0.1NA
D . 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
下列金属或氧化物可以完全溶解的是( )
A . 1molZn与含1molHCl的稀盐酸共热
B . 1molCu与含2molH2SO4的浓硫酸共热
C . 1molCu与含4molHNO3的浓硝酸
D . 1molMnO2与含4molHCl的浓盐酸共热
用下图装置进行浓硫酸和木炭反应的实验,并检验有CO2和SO2两种气体生成。
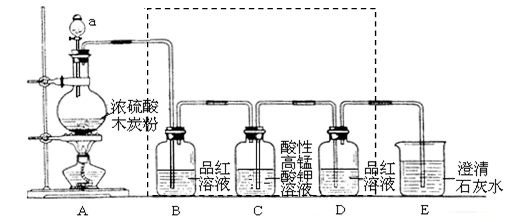
回答下列问题:
-
(1) 仪器a的名称为,A装置中反生反应的化学方程式为。
-
(2) 虚线框内有一处不
故答案为:,请指出,
装置B的作用是。
-
(3) 装置C中酸性KMnO4溶液用于除去SO2 , 其目的是。(填序号)
甲:防止SO2干扰CO2的检验 乙:吸收CO2气体 丙:检验SO2
-
(4) 装置E的现象是,E中发生反应的离子方程式为。
下列不属于硫酸的化学性质的是( )
A . 酸性
B . 强还原性
C . 脱水性
D . 吸水性
某同学在实验室选用下列实验装置,验证浓硫酸与碳反应[2H2SO4(浓)+C  CO2↑+2SO2↑+2H2O]的生成产物。下列说法正确的是( )
CO2↑+2SO2↑+2H2O]的生成产物。下列说法正确的是( )
 CO2↑+2SO2↑+2H2O]的生成产物。下列说法正确的是( )
CO2↑+2SO2↑+2H2O]的生成产物。下列说法正确的是( ) 
A . 浓硫酸与碳反应中浓硫酸表现出酸性和强氧化性
B . 验证产物的符合题意连接顺序可能为I→IV→III→II
C . 装置II中酸性高锰酸钾溶液左右品红溶液的作用不相同
D . 若连接顺序为I→II→III→IV,无法检验产物中有无CO2
蔗糖与浓硫酸反应的实验改进装置如图所示。下列说法错误的是( )

A . 浓硫酸在实验过程中体现了脱水性和强氧化性
B . 可以用足量品红溶液分离两种酸性氧化物
C . 出现澄清石灰水变浑浊的现象,说明反应产生了CO2
D . 虽然改进装置能够将有毒气体吸收,但仍需按要求规范操作
对下列事实的解释错误的是( )
A . 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B . 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C . 常温下,浓硝酸可以用铝制器皿贮存,说明铝与浓硝酸不反应
D . 将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,有白色沉淀,则通入的气体可能是NH3
关于非金属含氧酸及其盐的性质,下列说法正确的是( )
A . 浓H2SO4具有强吸水性,能吸收糖类化合物中的水分并使其炭化
B . NaClO、KClO3等氯的含氧酸盐的氧化性会随溶液的pH减小而增强
C . 加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强
D . 浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀HNO3氧化性更强
-
(1) 硅酸盐具有特殊的性质与应用,回答下列问题:
硅酸盐材料是传统无机非金属材料,下列产品属于硅酸盐的是(填序号)。
①玻璃 ②陶瓷 ③水晶 ④硅芯片 ⑤光导纤维 ⑥水泥 ⑦砖瓦
-
(2) SiO2是一种酸性氧化物。
①盛装NaOH溶液的试剂瓶(填“能”“不能”)用玻璃塞。
②熔化烧碱应选用的坩锅应该(填字母)
A.铁坩锅 B.玻璃坩锅 C.石英坩锅 D.瓷坩锅
-
(3) 某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质(夹持装置已略去)。
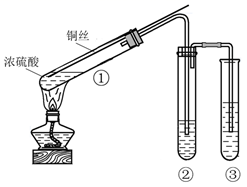
试管①中反应的化学方程式是;其中体现浓硫酸的性和性。
-
(4) 若试管②中的试剂为品红溶液,实验中观察到的现象是;证明生成的气体具有性。若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有性。
-
(5) 试管③中的试剂为NaOH溶液,其作用是,反应的离子方程式是。
下列物质的性质与用途有对应关系的是( )
A . 二氧化氯具有强氧化性,可用于自来水的杀菌消毒
B . 酒精具有挥发性,可用于消毒杀菌
C . 碳酸钠能与酸反应,可用于洗涤油污
D . 浓H2SO4具有脱水性,可用于干燥氯气
根据下列实验操作、现象及所得到的结论正确的是( )
选项 | 实验操作和现象 | 解释或结论 |
A | 工业上用SiO2与焦炭在高温条件制备粗硅,生成气体CO,得到黑色固体粗硅 | 非金属性:C>Si |
B | 将一块用砂纸打磨过的铝条放入试管,再加入98%浓硫酸3mL,铝条表面无明显现象 | 铝与浓硫酸常温下不反应 |
C | 将稀硝酸加入过量铁粉中,充分反应后再滴加KSCN溶液:有气体生成,溶液不呈血红色 | 稀硝酸只能将Fe氧化为Fe2+ |
D | 往烧杯中加入约20g研细的Ba(OH)2·8H2O晶体和10gNH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌;有刺激性气味气体生成,烧杯底部结冰,与玻璃片粘在一起 | 吸热反应不一定要加热才能进行 |
A . A
B . B
C . C
D . D
下列有关物质的性质与用途具有对应关系的是( )
A . 二氧化硫有还原性,可用作葡萄酒的抗氧化剂
B . 浓硫酸具有强氧化性,可用作酯化反应的催化剂
C . 硝酸见光易分解,可用于制氮肥
D . 氨气极易溶于水,可用作制冷剂
下列有关一些物质的性质说法正确的是( )
A .  能使鲜艳的红花褪色,说明
能使鲜艳的红花褪色,说明 具有漂白性
B . 加热条件下浓
具有漂白性
B . 加热条件下浓 能溶解金属铜,说明其具有强酸性
C . 常温下浓
能溶解金属铜,说明其具有强酸性
C . 常温下浓 能使金属铝钝化,可以用铝槽车运输浓
能使金属铝钝化,可以用铝槽车运输浓 D . 金属钠保存在煤油中,实验剩余的金属钠不能放回原瓶
D . 金属钠保存在煤油中,实验剩余的金属钠不能放回原瓶
 能使鲜艳的红花褪色,说明
能使鲜艳的红花褪色,说明 具有漂白性
B . 加热条件下浓
具有漂白性
B . 加热条件下浓 能溶解金属铜,说明其具有强酸性
C . 常温下浓
能溶解金属铜,说明其具有强酸性
C . 常温下浓 能使金属铝钝化,可以用铝槽车运输浓
能使金属铝钝化,可以用铝槽车运输浓 D . 金属钠保存在煤油中,实验剩余的金属钠不能放回原瓶
D . 金属钠保存在煤油中,实验剩余的金属钠不能放回原瓶
最近更新



