硫化氢 知识点
①受热易分H2S=H2+S
②可燃烧:
③还原性:硫化氢中硫显最低价、有强还原性,易被氧化,是强还原剂.
2H2S+SO2=2H2O+3S
H2S+Cl2=2HCl+S(Br2、I2发生类似反应)
H2S+H2SO4(浓)=S↓+SO2+2H2O (H2S不能用浓硫酸干燥)
④酸性:硫化氢的水溶液叫氢硫酸,氢硫酸是弱酸、有酸类通性和较强还原性.
硫化氢 知识点题库
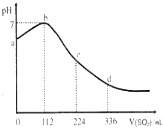
(1)向此溶液中加入适量浓溴水,溶液的pH值变 (大或小),溶液的颜色可能由 色变 色.
(2)向此溶液中通入足量的O2 , 溶液的pH值变 (大或小),该反应的化学方程式为
(3)向此溶液中加入少量Na2S晶体,溶液的pH值变
硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.

-
(1) H2S尾气常用烧碱溶液吸收处理.
①标准状况下,2.24LH2S气体通入100mL某浓度NaOH中,最后结晶获得固体质量为6.7g,则NaOH溶液的物质的量浓度为 .
②将烧碱吸收H2S后的溶液加入到如图1所示的电解池的阳极区进行电解.电解过程中阳极区发生如下反应:S2﹣﹣2e﹣═S;(n﹣1)S+S2﹣═S
 . 电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式为
. 电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式为 -
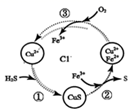
(2) 将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示.
①在图示的转化中,化合价不变的元素是
②反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为 .
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有
-
(3) H2S在高温下分解生成硫蒸气(Sx)和H2 . 若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图3所示,H2S在高温下分解反应的化学方程式为
请根据以上信息,结合学过的知识,回答下列问题:
-
(1) 事故发生后,若及时采取对逸出气体点火燃烧的措施,可以减少对人员的危害和死亡.写山逸出气体完全燃烧的化学方程:.
-
(2) 用点燃的方法可除去H2S气体,但生成的二氧化硫又可能造成的危害是.
-
(3) 专家提醒:发生H2S气体泄漏时,可用湿毛巾捂住鼻子迅速离开现场.这利做法的理由是.
-
(4) “井喷”事故发生后,村民虽已闻到弥漫在空气中的臭味,但直到几小时后,村干部通知他们迅速撤离,才意识到危险.对此,你对学习化学知识有何感想:.
![]()
| X | Y | Z | |
| A | H2S | S | SO2 |
| B | NH3 | NO | NO2 |
| C | Fe | FeCl2 | FeCl3 |
| D | Mg | C | CO |
-
(1) 写出硫与铁反应的化学方程式,所得产物的颜色为。
-
(2) 将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象是,硫化氢呈现(选填“氧化性”、“还原性”)。
-
(3) 二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是。
-
(4) 硫酸盐的种类很多,且应用广泛,医疗上采用作X射线透视肠胃的内服药剂。
①原气体中肯定有SO2 ②原气体中可能有SO2 ③原气体中肯定无H2S、HBr、NO2④不能肯定是否含有HCl ⑤原气体中肯定不含CO2 ⑥原气体中肯定含HCl

-
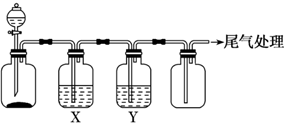
(1) 图中装置顺序错误的是;使用错误的药品是。
-
(2) 制取硫化氢的离子方程式为,制取二氧化硫的离子方程式为:。
-
(3) C中反应的化学方程式为: 。
-
(4) 将C导出的气体通入溶液可检验是否含有SO2。
-
(5) D中可选的干燥剂是,装置B的作用是,B中反应的离子方程式为:。
-
(6) 若用A代替D来干燥H2S产生的后果用化学方程式表示为:。
-
(7) 反应结束后,洗涤C瓶应先加入或。
| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Na2SO3与浓盐酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
| C | 用Zn粒和稀盐酸制取并收集纯净干燥的H2 | NaOH溶液 | 浓硫酸 |
| D | 用FeS固体和稀盐酸制取并收集纯净干燥的H2S | 饱和NaHS溶液 | 浓硫酸 |
 能使品红、溴水等物质褪色,体现了漂白性
B . 常温下浓硫酸可以用铝罐贮存,说明常温下铝与浓硫酸不反应
C . 浓硫酸能干燥
能使品红、溴水等物质褪色,体现了漂白性
B . 常温下浓硫酸可以用铝罐贮存,说明常温下铝与浓硫酸不反应
C . 浓硫酸能干燥  、
、  等气体,体现了浓硫酸的吸水性
D . 硫化氢水溶液有还原性,暴露在空气中往往会产生浑浊的现象
等气体,体现了浓硫酸的吸水性
D . 硫化氢水溶液有还原性,暴露在空气中往往会产生浑浊的现象
 微溶于酒精,易溶于
微溶于酒精,易溶于  B . 向
B . 向  的溶液中通入
的溶液中通入  ,可产生淡黄色沉淀
C . 滴加
,可产生淡黄色沉淀
C . 滴加  溶液,即可鉴别
溶液,即可鉴别 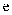 、
、 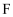 两种溶液
D . 在一定条件下,可实现
两种溶液
D . 在一定条件下,可实现  的转化
的转化



