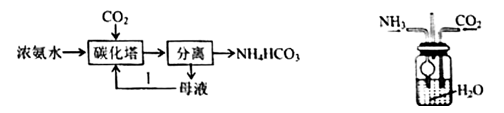
铵盐 知识点题库
选项 | 操作及现象 | 溶液 |
A | 通入SO2 , 溶液不变浑浊,再加氯水,变浑浊 | BaCl2溶液 |
B | 通入CO2 , 溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
C | 通入SO2 , 溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
D | 通入NH4HCO3受热分解产生的气体,溶液变浑浊,继续通入该气体,浑浊消失 | Ca(OH)2溶液 |
-
(1) 给农作物施用含氮量相同的下列化肥,肥效最差的是 .
A、NH4HCO3 B、NH4NO3 C、NH4HSO4 D、NH4Cl
-
(2) 在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的问题.解决方法是把这些陶土和水一起搅拌,使微粒直径为1~100nm,然后插入两根电极,接通直流电源,这时阴极聚集 ,理由是
-
(3) 氢氧化铁胶体稳定存在的主要原因是 .
A、胶粒直径小于1nm
B、胶粒做布朗运动
C、胶粒带正电荷
D、胶粒不能通过半透膜
-
(4) 溶液、胶体、浊液这三种分散系的最本质区别是 .
A、能否透过滤纸
B、是否为均一、稳定、透明的外观
C、是否会产生丁达尔效应
D、分散质粒子直径的大小.
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
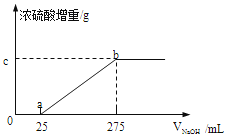
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出.(此温度下,铵盐不分解).该气体干燥后用足量的浓硫酸完全吸收.浓硫酸增重的质量与加入NaOH溶液的体积的关系如右图.分析该图象,并回答下列问题:
-
(1) 写出ab段涉及的离子方程式:
-
(2) c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为
-
(3) 乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收.测定结果如下表:
实验编号
Ⅰ
Ⅱ
Ⅲ
Ⅳ
铵盐的质量(g)
9.88
19.76
29.64
49.40
浓硫酸增加的质量(g)
m
m
1.36
0
分析该表,并回答下列问题:
(3)①分析实验数据可知,实验编号为 的实验中,氢氧化钠足量,铵盐中的铵根离子完全转化成气体;m的值为 .
②计算样品B中氮元素的质量分数.(用小数表示,保留两位小数)
-
(4) 乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系.假设样品的质量为x(g),浓硫酸增重的质量为y(g).求:当x在不同范围时y与x的函数关系.
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气.
-
(1) 氨的水溶液显弱碱性,其原因为(用离子方程式表示),0.1mol•L﹣1的氨水中加入少量的NH4Cl固体,溶液的pH(填“增大”或“减小”);若加入少量的明矾,溶液中的NH4+的浓度(填“增大”或“减小”).
-
(2) 硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为,平衡常数表达式为;若有1mol硝酸铵完全分解,转移的电子数为 mol.
-
(3) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:.
在汽车尾气系统中装置催化转化器,可有效降低NOx的排放.当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式:.
 NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
步骤1:按图连接好实验装置,……………………….。
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:
-
(1) 将步骤1补充完整:
-
(2) 干燥管中盛放的药品是
-
(3) 对比碳酸盐和酸反应制CO2 , 该实验利用干冰升华产生CO2气体的优点有(写出一种即可)。
-
(4) 三颈烧瓶中产生氨气的原理是。
-
(5) 反应后期随着产生CO2气流减慢,导致反应物比例不当,可采取的措施是。
-
(6) 尾气处理装置中双通玻璃管的作用是(用文字叙述),浓硫酸的作用是、。
-
(7) 取部分变质(混有碳酸氢铵的氨基甲酸铵)样品1.173g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。则样品中氨基甲酸铵的物质的量分数为。

| 选项 | A | B | C | D |
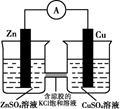
| 目的 | 验证锌与硫酸铜反应过程中有电子转移 | 探究亚硝酸钠的氧化性 | 实验室制备乙酸乙酯 | 实验室制备氨气 |
| 实验方案 | | | | |
①NH3易液化,液氨常用作制冷剂
②与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
③铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
④稀HNO3和活泼金属反应时主要得到氢气
①氮气与氧气在放电的条件下可直接生成NO2
②铵盐都不稳定,受热分解都生成氨气
③向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化
④实验室加热氯化铵固体,用碱石灰除氯化氢的方法制备氨气
⑤氨气有还原性,但是和硝酸发生的是非氧化还原反应
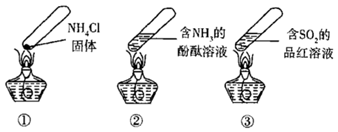
 固体
B . 加热时,②中溶液变红,冷却后又变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现
固体
B . 加热时,②中溶液变红,冷却后又变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现  的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测定0.1mol/LNH4HCO3溶液的pH,测得pH约为8 |
| 2 | 向0.1mol/LNH4HCO3溶液中加入等体积的0.1mol/L的盐酸,有气体放出 |
| 3 | 向0.1mol/LNH4HCO3溶液逐滴加入0.1mol/LNaOH溶液,有刺激性气味气体放出 |
| 4 | 向0.1mol/LNH4HCO3溶液中加入FeSO4溶液,得到白色沉淀 |
下列说法正确的是( )
 )>c(NH
)>c(NH  )
B . 实验2混合后的溶液中:c(NH
)
B . 实验2混合后的溶液中:c(NH  )+c(NH3·H2O)=c(Cl-)
C . 实验3产生的气体能使湿润的蓝色石蕊试纸变红
D . 实验4发生反应的离子方程式为Fe2++CO
)+c(NH3·H2O)=c(Cl-)
C . 实验3产生的气体能使湿润的蓝色石蕊试纸变红
D . 实验4发生反应的离子方程式为Fe2++CO 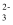 =FeCO3↓
=FeCO3↓