含氮物质的综合应用 知识点题库
-
(1) 脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
甲烷直接将NO2还原为N2的热化学方程式为.
-
(2) 脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是.
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 , 则c1与c2的比值等于.
-
(3) 脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol•L﹣1H2SO4溶液.电极c上发生的电极反应式为,当电池中有1mole﹣发生转移时左右两侧溶液的质量之差为g (假设反应物a、b耗尽,忽略气体的溶解).


-
(1) 装置A发生反应中氧化产物与还原产物的体积比是(相同条件下)。
-
(2) 装置B的作用是,反应一段时间后,将带火星的木条放入B中,木条复燃,说明该红棕色气体可助燃,原因是。
-
(3) 已知NO2和NaOH溶液反应可生成两种钠盐,装置C中发生的离子方程式为。
-
(4) 将反应后试管中的固体加水充分溶解、过滤、洗涤,向滤渣中加入一定量稀硫酸,发现固体全部溶解,得到蓝色溶液,分为两份。
①一份溶液经、、、洗涤得蓝色晶体。
②另一份取20mL溶液,加入过量KI,充分反应后,用0.5000mol·L-1的Na2S2O3溶液来滴定反应产物,终点时消耗Na2S2O3溶液40.00mL,则上述溶液中c(Cu2+)= mol·L-1。(已知2Cu2++4I-=2CuI↓+I2;I2+2S2O32-=21-+S4O62-)
 制备
制备  C . 用N2和H2合成氨
D . 豆科植物的根瘤菌把大气中的氮转化成氨
C . 用N2和H2合成氨
D . 豆科植物的根瘤菌把大气中的氮转化成氨

-
(1) 仪器 a 的名称为 。
-
(2) 实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 性,写出相应的化学方程式 。
-
(3) E 装置中浓硫酸的作用 。
-
(4) 读取气体体积前,应对装置 F 进行的操作:。
-
(5) 实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含 m、n 字母的代数式表示)
-
(6) 在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 。
A.Na2SO3 溶液与 HNO3 B.Na2SO3 固体与浓 H2SO4
C.碳与浓 H2SO4 D.铜与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 ,表明 SO2 的氧化性比 I2(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是(填化学式)。
④某硫酸厂拟用含 Cr2O72-的酸性废水处理烟气中 SO2 , 反应后的铬元素以 Cr3+形式存在, 则反应中氧化剂和还原剂的物质的量之比是 。

已知:①N2H4·H2O具有强还原性,易被氧化成N2。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4·H2O。
③尿素中氮元素为-3价。
回答下列问题:
-
(1) 吸收塔内发生反应的离子方程式为。
-
(2) 为提高吸收塔内NaOH的有效利用率,将二氧化锰和浓盐酸制取的Cl2通入吸收塔前应进行的操作是(填操作名称),选用的试剂是。
-
(3) 反应器内生成水合肼的化学方程式为。
-
(4) 制备过程中要控制反应器内NaClO溶液的供给量,其主要目的是(用离子方程式表示)。
-
(5) 副产品Na2SO3常用作还原性漂白剂。在测定某液体葡萄糖中Na2SO3残留量时,取50.00mL样品,先通入足量Cl2 , 再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式,为,该样品中Na2SO3残留量为g·L-1(以SO2计,结果保留1位小数)。

回答下列问题:
-
(1) 用装置A制备NH3,其中发生反应的化学方程式为;装置B内的试剂是
-
(2) 装置D中发生反应的离子方程式是,铜丝可抽动的优点是。
-
(3) NH3和NO2在M中充分反应后,产生两种对环境友好的物质,该反应的化学方程式为,M中可观察到的现象是。
 B .
B . 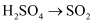 C .
C . 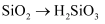 D .
D . 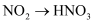

-
(1) 下列关于海洋中氮循环的说法错误的是(填字母)。
a.海洋中只存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.②中的含氮物质转化属于氮的固定化作用
d.向海洋排放含
 的废水会影响海洋中
的废水会影响海洋中  的含量
的含量 -
(2) 检验某溶液中是否含有
 的方法是 。
的方法是 。
-
(3) 铜与稀硝酸反应的离子方程式为 ,该反应体现了稀硝酸的性。
-
(4) 有氧时,在硝化细菌作用下
 可实现过程④的转化,将过程④的离子方程式补充完整并配平。 NH
可实现过程④的转化,将过程④的离子方程式补充完整并配平。 NH  +5O2⟶2NO
+5O2⟶2NO  +H++
+H++
该反应中每消耗0.05 mol
 ,转移电子的数目为 。
,转移电子的数目为 。
 会促进血管扩张,防止血管栓塞
C . 石膏可用于制造硫酸
D . 硫酸铜能杀死某些细菌,因此可用于饮用水消毒
会促进血管扩张,防止血管栓塞
C . 石膏可用于制造硫酸
D . 硫酸铜能杀死某些细菌,因此可用于饮用水消毒
 常采用还原法。
常采用还原法。
-
(1) I.不同密度的HNO3与Fe反应(相同温度)时还原产物成分分布情况如图示。

硝酸的密度越大,高含量产物中N元素的化合价越。
-
(2) 已知:硝酸的密度小于1.1g·cm-3时,Fe元素转化生成Fe2+。写出硝酸密度小于1.1g·cm-3时发生的主要反应的离子方程式。
-
(3) II.工业上利用铝粉(掺少量炭粉)处理酸性污水中的硝酸盐,脱硝率可达94%,其反应过程原理如图所示。

铝粉脱硝的过程可描述为。
-
(4) 酸性过强,不利于脱硝的原因是。

-
(1) 常温下,A、B、C、D均为气体;气体B溶于水显碱性;在雷雨天气,可发生反应②,则反应③的化学方程式为,D相对分子质量比C大16,则D为 (填化学式)。
-
(2) 若A是淡黄色固体,B为氢化物,常温下,D的浓溶液是一种无色黏稠油状液体。则反应③的化学方程式为。在加热条件下,D的浓溶液能与木炭发生反应生成C,D体现的性质为
-
(3) 若B是淡黄色固体,且②③的反应物中均有常温下为液态的一种物质。则反应③的化学反应方程式为。
-
(4) 若D为红褐色沉淀,且①的反应物有盐酸,向B溶液中入
 溶液的现象为。
溶液的现象为。
-
(5) 若A为金属单质,B为氧化物,D难溶于水且具有两性。若反应②③均在盐酸中完成,则C的化学式为。若反应②③均在
 溶液中完成,则C的化学式为。
溶液中完成,则C的化学式为。

-
(1) 常温下,A、B、C、D均为气体且A是无色无味的气体单质;气体B溶于水显碱性;在雷雨天气,可发生反应②。则反应③的化学方程式为,其中被氧化的物质为(填化学式)。
-
(2) 若A是淡黄色固体单质,B为氢化物,常温下,D的浓溶液是一种无色黏稠油状液体,则D的化学式为。在加热条件下,D的浓溶液能与木炭发生反应生成C,写出该反应的化学方程式:。
-
(3) A为单质,B为氧化物,D具有两性。
Ⅰ.若反应②③均在盐酸中完成,则C的化学式为。
Ⅱ.若反应②③均在NaOH溶液中完成,则C的化学式为,反应②的离子方程式为。

-
(1) Ⅰ.利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

质量相同的a和b,物质的量之比为。
-
(2) 将足量的a气体通入下列溶液中,始终没有明显反应现象的是____。A .
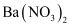 溶液
B .
溶液
B . 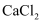 溶液
C . H2O2溶液
D . Na2CO3溶液
溶液
C . H2O2溶液
D . Na2CO3溶液
-
(3) 已知e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4 ,
 被还原为
被还原为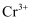 , 写出此反应的离子方程式:。
, 写出此反应的离子方程式:。
-
(4) Ⅱ.氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。

写出氧化炉中的化学反应方程式。
-
(5) 向吸收塔中通入A的作用。
-
(6) 工业制硝酸的尾气是酸性气体,实验室模拟该流程时,为防止环境污染,最好选用(填化学式)溶液吸收。
-
(1) I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:

图2中N所对应图1中物质的化学式为,Y与金属铜反应所得产物的化学式为。X与Z反应中氧化剂与还原剂的物质的量之比为。
-
(2) 碳和M的浓溶液反应生成Z的化学方程式为。
-
(3) 从分类角度分析判断,下列物质不属于酸性氧化物的是____。A .
 B .
B . 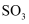 C .
C .  D .
D . 
-
(4) II.氮及其化合物在很多方面有广泛应用。
实验室常用
 与
与 制取氨气。证明氨气已集满的操作和现象是。
制取氨气。证明氨气已集满的操作和现象是。 -
(5) 含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:

请回答:
①根据下图判断,使用亚硝化菌的最佳条件为。

②利用微生物处理含氮废水的优点为。(答出2点即可)。
-
(6) 汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式。



