氯、溴、碘及其化合物的综合应用 知识点题库
(1)工业上将氯气通入石灰乳制取漂白粉,反应的化学方程式为: .
(2)漂白粉的有效成分是(填化学式) .
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 .
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) .
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降,取少许上层清液,滴加几滴酚酞溶液,发现溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈 性,并可能具有 性.
 B .
B .  C .
C .  D .
D . 
-
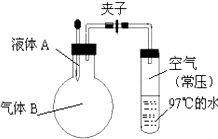
(1) 用于制造电池的原材料二氯亚砜(SOCl2),是一种液态化合物,沸点为77℃.在盛10mL水的锥形瓶中小心滴加8~10滴SOCl2可观察到剧烈反应,液面上形成白雾,并逸出刺激性气味的气体,该气体可使沾有品红试液的滤纸褪色.轻轻振荡锥形瓶,待白雾消失后往溶液中滴加AgNO3溶液,有不溶于稀HNO3的白色沉淀析出.室温下,小组某同学取2.38g SOCl2与水发生上述反应,测得放出热量为17.88kJ.根据以上实验,写出SOCl2与水反应的热化学方程式.
-
(2) 低温蒸干AlCl3溶液得到固体的主要成分是;小组某同学想制取无水AlCl3固体,他提出可以用AlCl3•6H2O与SOCl2混合后共热来制取无水AlCl3固体,你认为可行吗?请说明原因.
-
(3) TiO2是一种非常好的催化剂.某同学通过查阅资料显示:TiCl4水解程度很大,可以用于TiO2的制备,制备时加入大量的水,同时加热,促进水解趋于完全,所得TiO2•xH2O经焙烧得TiO2 . 请写出TiCl4水解的化学方程式
-
(4) 某同学利用NaCl溶液设计实验验证Fe在原电池反应中的生成物,使用Cu电极、Fe电极、经过酸化的3%NaCl溶液,组成原电池装置,实验结束后,该同学往Fe电极区滴入2滴黄色铁氰化钾溶液,现象是:.

-
(1) “反应2”的还原剂是,写出它的电子式,该反应的化学方程式为,原因是。
-
(2) 采取“减压蒸发”而不用“常压蒸发”,原因是。
-
(3) 从“母液”中可回收的主要物质是。
-
(4) “冷却结晶”后经(填操作名称)即可获得粗产品。

 B .
B .  C .
C .  D .
D . 
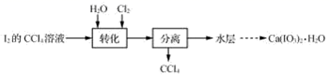
已知:碘酸是易溶于水的强酸,不溶于有机溶剂。
-
(1) 转化步骤是为了制得碘酸,该过程在图1所示的装置中进行。
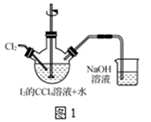
①当观察到现象时,停止通入氯气
②转化时发生反应的离子方程式为
-
(2) 除去HIO3水溶液中少量I2单质的实验操作为直至用淀粉溶液检验不出碘单质的存在。
已知:①Ca(IO3)2·6H2O是一种难溶于水的白色固体,在碱性条件下不稳定。
②Ca(IO3)2·6H2O加热升温过程中固体的质量变化如图2所示
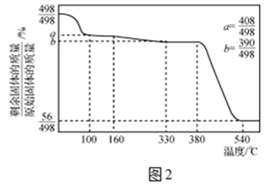
-
(3) Ca(IO)3·6H20在100~160℃条件下加热得到的物质成分是
-
(4) 下列说法正确的是_____________A . 转化过程中CCl4的作用只是增大I2的溶解量,提高I2的利用率 B . 为增大转化过程的反应速率,可适当加快通Cl2的速度 C . 以除碘后的水层为原料,加入过量的Ca(OH)2溶液,过滤,洗涤可得到Ca(IO3)2·6H2O D . 对已除碘后的水层为原料得到的沉淀Ca(IO3)2·6H2O进行洗涤,洗涤沉淀至洗涤后滤液滴加AgNO3溶液不再有沉淀产生

已知:①高氯酸:沸点90 ℃,浓度低于60%比较稳定,浓度高于60%遇含碳化合物易爆炸。
② 
回答下列问题:
-
(1) 仪器a的名称为。实验开始前,胶塞及导管接口必须包锡箔纸,其原因是。
-
(2) 写出装置A制备ClO2同时生成高氯酸的化学方程式:。
-
(3) 关闭止水夹②,打开止水夹①③,通空气一段时间,装置C中生成NaClO2 , 离子方程式为。若关闭止水夹③,打开止水夹②,B中可观察到的现象为。
-
(4) 从装置C反应后的溶液中获得NaClO2晶体,常采用减压蒸发结晶。采用减压蒸发的原因是,减压蒸发时,当有较多晶体析出时,再(填操作方法),洗涤,干燥。即可得NaClO2。
-
(5) 城市饮用水处理新技术用NaClO2、高铁酸钠替代Cl2。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,NaClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是。
-
(6) ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样量取V0mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用cmol·L−1Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1mL。
已知:2ClO2+10I−+8H+=2Cl−+5I2+4H2O,2Na2S2O3+I2=Na2S4O6+2NaI,计算该ClO2的浓度为g/L(用含字母的代数式表示,计算结果化简)。
 价离子
B . 都只能从海洋中提取
C . 单质熔沸点依次上升
D . 气态氢化物稳定性依次减弱
价离子
B . 都只能从海洋中提取
C . 单质熔沸点依次上升
D . 气态氢化物稳定性依次减弱
方法Ⅰ NaClO + 2HCl(浓) = NaCl + Cl2↑ + H2O;
方法Ⅱ 4HCl(g) + O2(g) = 2H2O(g) + 2Cl2(g) ΔH = a kJ·mol−1
上述两种方法涉及的反应在一定条件下均能自发进行。下列关于氯及其化合物的性质与用途具有对应关系的是( )

请回答下列问题:
-
(1) 将海水中的
 “富集”得到悬浊液,有关反应的离子方程式是。
“富集”得到悬浊液,有关反应的离子方程式是。
-
(2) “转化”时用铁粉而不用铁片的原因是。
-
(3)
 进入“氧化”环节,通过控制
进入“氧化”环节,通过控制 的用量生成
的用量生成 , 此反应的化学方程式是,反应中的氧化剂是。
, 此反应的化学方程式是,反应中的氧化剂是。
-
(4) 欲判断经一系列处理后的水溶液中是否含有
 , 应进行的操作是。
, 应进行的操作是。



