金属键 知识点
金属键 知识点题库

-
(1) 基态Ti原子核外电子排布的最高能级符号是。与钛同周期元素中,基态原子的未成对电子数与钛相同的有种。
-
(2) 钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是
-
(3) 催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。

①M中,碳原子的杂化形式有种。
②M中,不含(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
-
(4) 金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①4个微粒A,B,C,D中,属于氧原子的是
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,,);钛氧键键长d=(用代数式表示)。
-
(1) 属于原子晶体的化合物是(填字母,下同),受热熔化后化学键不发生变化的是。
-
(2) 1mol SiO2 含有mol Si—O 键,1mol 白磷(P4)含有mol P—P 键。
-
(3) 从原子半径大小角度解释,同一主族的 C 与 Si,形成 CO2 和 SiO2 时,C、O 原子间 能形成π键,而 Si、O 之间不能的原因。
-
(4) 升高温度,金属铝的电导率(填“升高”、“降低”或“不变”)。
回答下列问题:
-
(1) 金属铁可导电、导热,具有金属光泽,有延展性,这些性质都可以用“理论”解释。
-
(2) SiO2硬而脆,其原因是。
-
(3) Ca、Fe、K、Zn的第一电离能由大到小的顺序为。
-
(4) O、Si、P、S四种元素形成的最简单氢化物的稳定性最强的是 (填化学式);P4难溶于水却易溶于CS2 , 其原因为。
-
(5) PO
 的空间构型为,酸性条件下,PO
的空间构型为,酸性条件下,PO  可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+ , 基态Fe3+核外M层有种空间运动状态不同的电子。
可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+ , 基态Fe3+核外M层有种空间运动状态不同的电子。
-
(1) 钛的应用越来越受到人们的关注。
①第四周期元素中,基态原子的未成对电子数与钛相同的有(填元素符号)。
②钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是。
-
(2) 锰及其化合物的应用研究是前沿科学之一
①已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列(选填字母编号)。

②三醋酸锰[(CH3COO)3Mn]是一种很好的有机反应氧化剂。三醋酸锰[(CH3COO)3Mn]中阳离子的价层电子排布式中电子的自旋状态(填“相同”或“相反”)。
③Mn2+能形成配离子为八面体的配合物MnClm·nNH3 , 在该配合物的配离子中,Mn2+位于八面体的中心。若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1mol AgCl沉淀,则该配离子化学式为。
-
(3) 比较Fe和Mn的第三电离能,I3(Fe)I3(Mn)(填“大于”或“小于”),原因是。
-
(4) 某钙钛型复合氧化物如图,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有巨磁电阻效应。

已知La为+3价,当被钙等+2价元素A替代时,可形成复合钙钛矿化合物LaxA1-xMnO3 , (x>0.9),此时一部分+3价锰转变为+4价,导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则复合钙钛矿化合物中+3价锰与+4价锰的物质的量之比为(用含x的代数式表示)。
-
(5) 具有较高催化活性的材料金红石的晶胞结构如图所示。已知该晶体的密度为d g·cm-3 , Ti、O原子半径分别为a pm和b pm,阿伏加德罗常数的值为NA , 则金红石晶体的空间利用率为(列出计算式)。

 均为元素周期表第II A族元素。回答下列问题:
均为元素周期表第II A族元素。回答下列问题:
-
(1) 基态
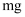 原子L能层有个运动状态不同的电子,
原子L能层有个运动状态不同的电子, 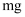 的第一电离能(填“大于”或“小于”)
的第一电离能(填“大于”或“小于”) 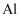 的第一电离能。
的第一电离能。
-
(2)
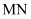 和
和 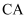 位于同一周期,且核外最外层电子排布相同,但金属
位于同一周期,且核外最外层电子排布相同,但金属 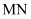 的熔、沸点等都比金属
的熔、沸点等都比金属 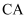 的高,原因是。
的高,原因是。
-
(3) 氯气与熟石灰反应制漂白粉时会生成副产物
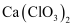 ,
, 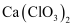 中电负性最小的元素是(填元素符号);
中电负性最小的元素是(填元素符号);  的空间构型是;
的空间构型是; 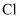 原子的杂化方式为。
原子的杂化方式为。
-
(4) 离子化合物
 的晶体结构如图所示。
的晶体结构如图所示。  中的作用力为,从钙离子看该晶体属于堆积,一个晶胞中含有的π键有个。
中的作用力为,从钙离子看该晶体属于堆积,一个晶胞中含有的π键有个。 
-
(5) 镁单质晶体中原子的堆积模型如图,已知图中底边长为
 ,高为
,高为  ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为  ,则镁的密度为(用含
,则镁的密度为(用含  、a、b的计算式表示)。
、a、b的计算式表示)。 
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
 的沸点高于
的沸点高于 是因为其范德华力更大
D . 离子键无方向性和饱和性,而共价键有方向性和饱和性
是因为其范德华力更大
D . 离子键无方向性和饱和性,而共价键有方向性和饱和性
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
-
(1) 基态O原子的电子排布式,其中未成对电子有个。
-
(2) Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是。
-
(3) 酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。邻苯二甲酸酐(
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(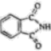 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。
-
(4) 金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。
-
(5) ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。
-
(6) 下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。



