物质的检验和鉴别 知识点题库
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4 , 可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3 , 取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3 .

以下说法正确的是( )

步骤1:
加入试剂 | 被检出物质的化学式 | 离子方程式 |
水 | ﹣﹣﹣﹣ |
步骤2:
加入试剂 | 被检出物质的化学式 | 离子方程式 |
步骤3:
加入试剂 | 被检出物质的化学式 | 离子方程式 |
①将四种盐各取少量,分别溶于盛有5mL蒸馏水的四支试管中,只有B盐溶液呈蓝色.
②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.
-
(1) 根据上述事实,推断这四种盐的化学式分别为:
A B C D
-
(2) 写出实验步骤②中涉及到的所有反应的离子方程式:.
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
B | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中,变浑浊 | 该溶液中一定含有CO32- |
C | 向某溶液中加入NaOH浓溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
D | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色 | 该溶液一定是钠盐 |

下列推断错误的是( )
 、
、  、
、  、
、 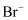 、
、  、
、 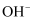 ,现进行如下实验:
,现进行如下实验: ①取适量该溶液,加入过量的  溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
②过滤出①中沉淀,向滤液中通入过量的  ,又生成白色沉淀。
,又生成白色沉淀。
③另取原溶液于试管中,加入足量氯水,再加入  溶液,振荡静置,下层为橙红色。
溶液,振荡静置,下层为橙红色。
根据上述实验回答:
-
(1) 溶液中一定大量存在的离子有 。
-
(2) 写出②中生成沉淀的离子方程式 。
-
(3) 如何检验未确定的离子是否存在? 。
 、Clˉ、CO
、Clˉ、CO  和HCO
和HCO  离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于硝酸):
离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于硝酸): ①向溶液中滴加少量 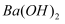 溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001 mol·Lˉ1 AgNO3溶液,有白色沉淀生成。
下列说法错误的是( )
 和Clˉ
B . 溶液A中不存在Mg2+、CO
和Clˉ
B . 溶液A中不存在Mg2+、CO  和HCO
和HCO  ,不能确定Na+的存在
C . 第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D . 溶液A中存在Fe2+与Cu2+中的一种或两种,且可用NaOH溶液判断
,不能确定Na+的存在
C . 第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D . 溶液A中存在Fe2+与Cu2+中的一种或两种,且可用NaOH溶液判断
 、
、  、
、  、NaCl这四种物质的溶液,这种试剂为( )
、NaCl这四种物质的溶液,这种试剂为( )
 溶液
C .
溶液
C . 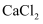 溶液
D .
溶液
D . 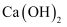 溶液
溶液
选项 | 实验目的 | 实验操作 |
A | 除去一氧化氮中的二氧化氮 | 将混合气体通入水中 |
B | 除去二氧化硫中的二氧化碳 | 将混合气体通入氢氧化钠溶液 |
C | 鉴别甲烷和乙烯 | 分别通入酸性高锰酸钾溶液 |
D | 除去乙醇中少量的水 | 加足量生石灰,蒸馏 |



