化学基本反应类型 知识点题库
卤代烃的制备有多种方法,下列卤代烃不适合由相应的烃经卤代反应制得的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
下列基本反应类型中,一定是氧化还原反应的是( )
A . 复分解反应
B . 置换反应
C . 分解反应
D . 化合反应
认识物质及其变化对把握自然规律至关重要.下列与其他物质变化类型不同的一项是( )
A .  对着干燥的玻璃片哈气
B .
对着干燥的玻璃片哈气
B .  浓硫酸腐蚀纸张
C .
浓硫酸腐蚀纸张
C .  用合金在纯金属上刻画
D .
用合金在纯金属上刻画
D .  胆矾的研碎
胆矾的研碎
 对着干燥的玻璃片哈气
B .
对着干燥的玻璃片哈气
B .  浓硫酸腐蚀纸张
C .
浓硫酸腐蚀纸张
C .  用合金在纯金属上刻画
D .
用合金在纯金属上刻画
D .  胆矾的研碎
胆矾的研碎
现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )

A . A铁
B . B盐酸
C . C氢氧化钠溶液
D . D硝酸银溶液
将燃着的镁条伸入盛有二氧化碳的集气瓶中,镁条继续燃烧,反应的化学方程式为CO2+2Mg  C+2MgO,该反应属于( )
C+2MgO,该反应属于( )
 C+2MgO,该反应属于( )
C+2MgO,该反应属于( ) ①化合反应 ②分解反应 ③置换反应 ④复分解反应 ⑤氧化还原反应 ⑥离子反应 ⑦非氧化还原反应.
A . ①③⑦
B . ②③⑥
C . ③⑤
D . ④⑥
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )

A . 4Fe(0H)2+O2+2H2O═4Fe(OH)3
B . 2H2O2  2H2O+O2↑
C . 3CO+Fe2O3
2H2O+O2↑
C . 3CO+Fe2O3  3CO2+2Fe
D . Zn+H2SO4═ZnSO4+H2↑
3CO2+2Fe
D . Zn+H2SO4═ZnSO4+H2↑
 2H2O+O2↑
C . 3CO+Fe2O3
2H2O+O2↑
C . 3CO+Fe2O3  3CO2+2Fe
D . Zn+H2SO4═ZnSO4+H2↑
3CO2+2Fe
D . Zn+H2SO4═ZnSO4+H2↑
“探险队员”﹣﹣盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过.

-
(1) 请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线).
-
(2) 在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有个,属于氧化还原反应的有个,其中能“吃掉”盐酸的盐是,写出该反应的化学方程式:.
下列反应属于化合反应的是( )
A . 2Mg+O2 2MgO
B . 2Al+Fe2O3
2MgO
B . 2Al+Fe2O3  Al2O3+2Fe
C . CaCO3
Al2O3+2Fe
C . CaCO3  CaO+CO2↑
D . KCl + AgNO3 = KNO3+AgCl↓
CaO+CO2↑
D . KCl + AgNO3 = KNO3+AgCl↓
 Al2O3+2Fe
C . CaCO3
Al2O3+2Fe
C . CaCO3  CaO+CO2↑
D . KCl + AgNO3 = KNO3+AgCl↓
CaO+CO2↑
D . KCl + AgNO3 = KNO3+AgCl↓
下列不能通过单质间反应而制得的物质是( )
A . CuCl2
B . CuS
C . FeCl3
D . FeS
反应  的反应类型是( )
的反应类型是( )
A . 加成反应
B . 取代反应
C . 化合反应
D . 分解反应
物质之间发生化学反应时,一定发生变化的是( )
A . 总物质的量
B . 原子个数
C . 化学键
D . 化合价
现有A、B、C、D四种物质,他们是Fe、稀盐酸、NaOH溶液、AgNO3溶液四种物质中的一种,它们的反应关系及反应类型如图所示,则物质B为( )
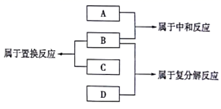
A . Fe
B . 稀盐酸
C . NaOH溶液
D . AgNO3溶液
从海水中提取溴有如下反应: 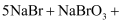
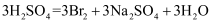 。下列反应中与该反应在氧化还原反应原理上最相似的是( )
。下列反应中与该反应在氧化还原反应原理上最相似的是( )
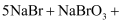
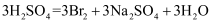 。下列反应中与该反应在氧化还原反应原理上最相似的是( )
。下列反应中与该反应在氧化还原反应原理上最相似的是( )
A . 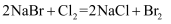 B .
B .  C .
C . 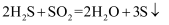 D .
D . 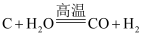
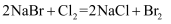 B .
B .  C .
C . 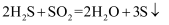 D .
D . 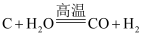
镁元素又称“国防元素”,可用于制造汽车、飞机、火箭等,目前世界上60%的镁是从海水提取的。海水提镁的主要流程如图:

其中说法正确的是( )
A . 上面反应涉及到四大基本反应和氧化还原反应
B . 从MgCl2·6H2O到MgCl2的变化是物理变化
C . 过滤需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
D . 反应①的离子方程式为:Mg2++2OH-=Mg(OH)2↓
下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是( )

A . 氧化物、化合物、纯净物
B . 钠盐、盐、化合物
C . 复分解反应、置换反应、化学反应
D . 碱性氧化物、金属氧化物、氧化物
下列各项前后两个反应的反应类型相同的是( )
A . 乙酸乙酯与稀硫酸混合水浴加热,氯乙烷与 水溶液共热
B . 乙醇与浓硫酸共热至
水溶液共热
B . 乙醇与浓硫酸共热至 , 乙醛与新制
, 乙醛与新制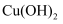 悬浊液共热
C . 乙醇通过灼热的氧化铜粉末,氯乙烯制备聚氯乙烯
D . 乙烯使澳水褪色,乙醛使酸性高锰酸钾溶液褪色
悬浊液共热
C . 乙醇通过灼热的氧化铜粉末,氯乙烯制备聚氯乙烯
D . 乙烯使澳水褪色,乙醛使酸性高锰酸钾溶液褪色
 水溶液共热
B . 乙醇与浓硫酸共热至
水溶液共热
B . 乙醇与浓硫酸共热至 , 乙醛与新制
, 乙醛与新制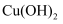 悬浊液共热
C . 乙醇通过灼热的氧化铜粉末,氯乙烯制备聚氯乙烯
D . 乙烯使澳水褪色,乙醛使酸性高锰酸钾溶液褪色
悬浊液共热
C . 乙醇通过灼热的氧化铜粉末,氯乙烯制备聚氯乙烯
D . 乙烯使澳水褪色,乙醛使酸性高锰酸钾溶液褪色
高纯硅是制备半导体材料的重要物质,工业上制备纯硅的方程式为 、
、 。得到硅单质的反应属于( )
。得到硅单质的反应属于( )
 、
、 。得到硅单质的反应属于( )
。得到硅单质的反应属于( )
A . 化合反应
B . 分解反应
C . 置换反应
D . 复分解反应
炼铁过程中存在反应:CaO+SiO2 CaSiO3.该反应属于( )
CaSiO3.该反应属于( )
 CaSiO3.该反应属于( )
CaSiO3.该反应属于( )
A . 化合反应
B . 分解反应
C . 置换反应
D . 复分解反应
下列关于氧化还原反应与四种基本反应类型的关系,说法正确的是( )
A . 化合反应都是氧化还原反应
B . 有单质生成的分解反应一定是氧化还原反应
C . 有一些置换反应不是氧化还原反应
D . 有氧元素参与的复分解反应是氧化还原反应
在纯碱工业的发展史上,法国的路布兰、比利时的索尔维和我国的侯德榜等科学家都取得了卓越的成就。
-
(1) 【方法一】路布兰以食盐、浓硫酸、焦炭和石灰石为原料,制得了纯碱。其反应原理为
①2NaCl+H2SO4(浓)
 Na2SO4+2HCl
Na2SO4+2HCl②2Na2SO4+4C
 Na2S+4CO↑
Na2S+4CO↑③Na2S+CaCO3
 Na2CO3+CaS
Na2CO3+CaS写出反应③的基本反应类型
-
(2) 用单线桥法表示反应②的电子转移方向和数目
-
(3) 【方法二】索尔维和侯德榜又发明了新的制碱方法,其模拟流程如下:

【资料查阅】
I.通常情况下,1体积水中大约能溶解700体积氨气,1体积水中大约能溶解1体积二氧化碳。
Ⅱ.饱和食盐水中发生的主要反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。
上述流程中过程②的主要操作的名称是,可以循环利用的物质是(填化学式)。
-
(4) 写出饱和食盐水中主要反应的离子方程式
-
(5) 为了提高产率,往饱和食盐水中通入气体时,你认为应该先通入(填“NH3”或“CO2”),你的理由是。
-
(6) 母液的主要成分为NH4Cl和NaCl,写出在加热条件下母液与石灰乳反应的化学方程式。
最近更新



