氧化还原反应 知识点题库
某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化,试根据下列三个反应判断,可选用的氧化剂是()
①2Fe3++2I-=2Fe2++I2②2Fe2++Cl2=2Fe3++2I-③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
①2Fe3++2I-=2Fe2++I2②2Fe2++Cl2=2Fe3++2I-③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
A . FeCl2
B . KMnO4
C . 浓盐酸
D . FeCl3
工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO ﹣、ClO 3﹣的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )

A . HClO具有强氧化性,而NaClO没有氧化性
B . 向漂白液中加入足量浓盐酸可增强漂白效果
C . 无法求出a点时的溶液中,c( Na+ )和 c(Cl﹣)的比值
D . t 2到t 4 , n( ClO ﹣ )下降的原因可能是:3ClO ﹣═2Cl﹣+ClO 3﹣
苹果汁中含有Fe2+ , 现榨的苹果汁在空气中会由浅绿色变为棕黄色.若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )
A . 氧化性
B . 还原性
C . 碱性
D . 酸性
工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为:4NH3+5O2 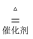 4NO+6H2O该反应的氧化剂为,还原剂为.用单线桥法表示该氧化还原反应电子转移的方向和数目:.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为(写出含字母的表达式).
4NO+6H2O该反应的氧化剂为,还原剂为.用单线桥法表示该氧化还原反应电子转移的方向和数目:.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为(写出含字母的表达式).
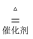 4NO+6H2O该反应的氧化剂为,还原剂为.用单线桥法表示该氧化还原反应电子转移的方向和数目:.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为(写出含字母的表达式).
4NO+6H2O该反应的氧化剂为,还原剂为.用单线桥法表示该氧化还原反应电子转移的方向和数目:.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为(写出含字母的表达式).
下列反应是氧化还原反应的是( )
A . Cu2(OH)2CO3═2CuO+H2O+CO2↑
B . Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
C . CO2+Ca(OH)2=CaCO3↓+H2O
D . 2Al+Fe2O3═Al2O3+2Fe
某反应体系的物质有H2SO4、Cu2O、Fe2(SO4)3、CuSO4、FeSO4、H2O.
-
(1) 请将Cu2O之外反应物与生成物分别填入横线内并配平.
++→ ++
-
(2) 反应中,被还原的元素是,还原剂是.
-
(3) 每1molCu2O完全反应,转移的电子数目为
某国外化学教材中有一张关于氧化还原反应的插图:由图可知,  在该反应中是( )
在该反应中是( )

A . 还原剂
B . 氧化剂
C . 氧化产物
D . 还原产物
由二氧化硅制高纯硅的流程如下,下列判断中错误的是( )

A . ①②③均属于氧化还原反应
B . H2和HCl均可循环利用
C . SiO2是一种坚硬难熔的固体
D . SiHCl3摩尔质量为135.5g
维生素C又称“抗坏血酸”,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+ , 这说明维生素C( )
A . 具有氧化性
B . 具有还原性
C . 既有氧化性,又有还原性
D . 具有酸性
下列物质长期露置于空气中会变质,但不是发生氧化还原反应的是( )
A . Na
B . 氯水
C . FeSO4
D . NaOH
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂;是还原剂;元素被氧化;元素被还原;是氧化产物;是还原产物;电子转移的总数为。
在反应3Cl2+2FeBr2=2FeCl3+2Br2中被还原的元素是( )
A . Fe
B . Fe和Cl
C . Cl
D . Br
将一小块钠投入水中,发生反应:2Na+2H2O=2NaOH+H2↑,该反应的还原剂是( )
A . Na
B . H2O
C . NaOH
D . H2
用双线桥标出电子转移的方向和数目,并指出氧化剂和还原剂,氧化产物和还原产物。
Fe2O3+3CO  2Fe+3CO2。
2Fe+3CO2。
氧化剂:;还原剂:;氧化产物:;还原产物:;用双线桥标出电子转移的方向和数目:。
下列反应中,不属于氧化还原反应的是 ( )
A . 2KClO3  2KCl+3O2↑
B . 3CO+Fe2O3
2KCl+3O2↑
B . 3CO+Fe2O3  2Fe+3CO2
C . CaCO3+SiO2
2Fe+3CO2
C . CaCO3+SiO2  CaSiO3+CO2↑
D . Zn+H2SO4=ZnSO4+H2↑
CaSiO3+CO2↑
D . Zn+H2SO4=ZnSO4+H2↑
 2KCl+3O2↑
B . 3CO+Fe2O3
2KCl+3O2↑
B . 3CO+Fe2O3  2Fe+3CO2
C . CaCO3+SiO2
2Fe+3CO2
C . CaCO3+SiO2  CaSiO3+CO2↑
D . Zn+H2SO4=ZnSO4+H2↑
CaSiO3+CO2↑
D . Zn+H2SO4=ZnSO4+H2↑
下列说法错误的是( )
A . 山西博物院陈列的元青花瓷的原料有高岭土[Al2Si2O5(OH)4],也可以表示为Al2O3·2SiO2·2H2O
B . 氮的三种固定方式,都发生了氧化还原反应
C . 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
D . 现代信息社会用于传递信号的光纤的主要成分为硅
某化学兴趣小组探究84消毒液(含10.5%NaClO和少量NaOH)与75%医用酒精能否反应,进行如下实验:

-
(1) 将25mL无水乙醇配成75%医用酒精,下列仪器中不需要使用的有(填名称)。

-
(2) 实验Ⅰ的淀粉碘化钾试纸在3min时变蓝,21min后蓝色褪去,实验Ⅱ则在8min时变蓝,49min后褪色。
①实验中,使淀粉碘化钾试纸变蓝的物质是,而后碘被(填“氧化”或“还原”)导致蓝色褪去。
②对比实验Ⅰ和Ⅱ的现象可以说明乙醇被NaClO氧化,理由是。
③实验过程,测得实验Ⅰ中混合溶液的pH由12.38逐渐增大至12.80,说明乙醇与NaClO反应可能生成。
-
(3) 为了测定84消毒液与医用酒精1:1反应后溶液中剩余NaClO含量:取5.00mL反应后溶液(密度约1g·mL-1)于锥形瓶,加入过量KI溶液和适量硫酸,在冷暗处静置4-5min后,再加入少量淀粉指示剂,用0.1000mol·L-1Na2S2O3标准液滴定,消耗标准液体积为14.80mL。
①滴定前,将锥形瓶置于“冷暗处”的目的是,写出NaClO与KI反应的离子方程式。
②滴定终点溶液的颜色是,84消毒液与医用酒精1:1反应后溶液中NaClO的质量分数=(结果保留3位有效数字;I2+2S2O
 =2I-+S4O
=2I-+S4O 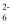 )。
)。
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多3.5 mol,则下列判断错误的是( )
A . 生成89.6 LN2 (标准状况)
B . 有0.5 molKNO3被还原
C . 转移电子的物质的量为1.25 mol
D . 被氧化的N原子的物质的量为7.5 mol
下列说法错误的是( )
A . 月饼包装中的脱氧剂主要成分是铁粉,为了防止月饼氧化而变质
B . 在节假日里燃放的烟花利用了一些金属的焰色反应
C . FeCl3、FeCl2均能通过两种物质直接化合制取
D . 金属钠着火时,可用泡沫灭火器扑灭
中国自古有“信口雌黄”“雄黄入药”之说。雌黄 和雄黄
和雄黄 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有
都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有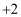 、
、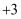 两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。下列说法不正确的是( )
两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。下列说法不正确的是( )
 和雄黄
和雄黄 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有
都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有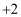 、
、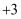 两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。下列说法不正确的是( )
两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。下列说法不正确的是( )
A . 反应Ⅰ中, 和
和 的物质的量之比为1∶1时可恰好完全反应
B . 反应Ⅱ中,物质a可能是S、
的物质的量之比为1∶1时可恰好完全反应
B . 反应Ⅱ中,物质a可能是S、 C . 反应Ⅰ、Ⅱ、Ⅳ是氧化还原反应;反应Ⅲ是非氧化还原反应
D . 反应Ⅰ可用NaOH溶液吸收
C . 反应Ⅰ、Ⅱ、Ⅳ是氧化还原反应;反应Ⅲ是非氧化还原反应
D . 反应Ⅰ可用NaOH溶液吸收 , 向吸收后的溶液中加入足量稀硫酸可为反应Ⅳ提供
, 向吸收后的溶液中加入足量稀硫酸可为反应Ⅳ提供
 和
和 的物质的量之比为1∶1时可恰好完全反应
B . 反应Ⅱ中,物质a可能是S、
的物质的量之比为1∶1时可恰好完全反应
B . 反应Ⅱ中,物质a可能是S、 C . 反应Ⅰ、Ⅱ、Ⅳ是氧化还原反应;反应Ⅲ是非氧化还原反应
D . 反应Ⅰ可用NaOH溶液吸收
C . 反应Ⅰ、Ⅱ、Ⅳ是氧化还原反应;反应Ⅲ是非氧化还原反应
D . 反应Ⅰ可用NaOH溶液吸收 , 向吸收后的溶液中加入足量稀硫酸可为反应Ⅳ提供
, 向吸收后的溶液中加入足量稀硫酸可为反应Ⅳ提供
最近更新



