氧化性、还原性强弱的比较 知识点题库
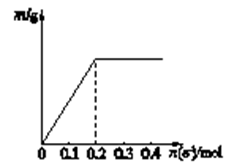
用Pt电极电解含有Ag+、Cu2+和X3+各0.1mol的溶液,阴极析出固体物质的质量m(g)与回路中通过电子的物质的量n(mol)的关系如图所示.则下列氧化性强弱的判断正确的是( )

①2FeCl3+2KI=2FeCl2+2KCl+I2 , ②2FeCl2+Cl2=2FeCl3 .
下列各微粒氧化能力由强到弱的顺序正确的是( )
①Al,Fe ②Cl2 , S ③Mg,C ④H2 , Cu ⑤C,Si.
①粒子半径:S2﹣>Cl>S ②氢化物稳定性:HF>HCl>PH3;
③离子还原性:S2﹣>Cl﹣>Br﹣>I﹣ ④单质氧化性:Cl2>S;
⑤酸性:H2SO4>HClO4 ⑥碱性强弱:KOH>NaOH>Mg(OH)2 .
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
①16H++10Z-+2XO4-=2X2++5Z2+8H2O ②2A2++B2=2A3++2B-
③2B- + Z2 = B2 +2Z-由此推断,下列说法中正确的是( )
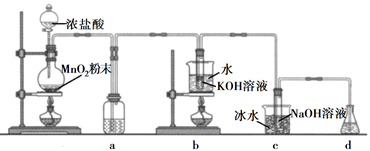
回答下列问题:
-
(1) 盛放MnO2粉末的仪器名称是,a中的试剂为。
-
(2) b中采用的加热方式是,c中化学反应的离子方程式是,采用冰水浴冷却的目的是。
-
(3) d的作用是,可选用试剂(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
-
(4) 反应结束后,取出b中试管,经冷却结晶,,,干燥,得到KClO3晶体。
-
(5) 取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显色。可知该条件下KClO3的氧化能力NaClO(填“大于”或“小于")。
 K2S+N2↑+3CO2↑。该反应的氧化剂是( )
K2S+N2↑+3CO2↑。该反应的氧化剂是( )
-
(1) 黑火药是我国古代科技四大发明之一,在化学史上占有重要地位,黑火药主要是硝酸钾、硫磺、木炭三者 粉末的混合物,在点燃条件下,其化学反应式主要为:KNO3+S+C→N2↑+CO2↑+K2S
试填写下列空白:
①在黑火药燃烧的反应中,氧化剂为,被氧化的物质为。
②根据化学反应式分析,一个硫原子参与反应时(得到或失去)个电子。
-
(2) 过氧化氢(H2O2 , 氧显-1 价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2 =2Ag+O2↑+H2O
B.2H2O2 =2H2O+O2 ↑
C.3H2O2 +Cr2(SO4)3+10KOH=2K2CrO4 +3K2SO4 +8H2O
①上述反应中,H2O2 分别表现的性质。A;B ;C。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序。
 2LiFePO4+H2O+3CO2↑。下列说法错误的是( )
2LiFePO4+H2O+3CO2↑。下列说法错误的是( )
-
(1) 写出H2O2在二氧化锰作催化剂的条件下分解的方程式,并在方程式上用双线桥法标出电子转移的方向和数目取少量H2O2于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:_H2O2 +_Fe2++_OH-=_Fe(OH)3 , ,该反应中H2O2表现了性(填“氧化”或“还原”)。
-
(2) 工业制CuSO4时,不是直接用铜跟浓硫酸在加热条件下反应,而是将铜丝浸入稀硫酸中,再不断由容器下部吹入细小的空气泡。
写出所发生反应的化学方程式
-
(3) 这样做的好处是①②
-
(4) 实验室常用浓硝酸与铜反应制备二氧化氮,离子方程式是。若有1.5molCu参加反应,则mol硝酸作氧化剂,转移 mol电子
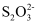 +O2+xOH-=Fe3O4+
+O2+xOH-=Fe3O4+  +2H2O,下列说法错误的是( )
+2H2O,下列说法错误的是( )
 都是还原剂
C . 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为
都是还原剂
C . 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为 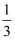 mol
D . x=4
mol
D . x=4
-
(1) 亚硝酸钠(
 )是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
)是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。 ①亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,从而使血红蛋白丧失输送氧气的能力而使人体中毒;一旦发生亚硝酸盐中毒,可立即注射美蓝溶液进行解毒治疗,试推断美蓝溶液具有(填“氧化”或“还原”)性。
②亚硝酸钠外观极像食盐,工业上检验食盐中是否混有亚硝酸钠的方法是:取样品,加淀粉碘化钾溶液,酸化后溶液(描述现象),说明样品中含有亚硝酸钠。
-
(2) 饮用水中的
 对人类健康会产生危害,为降低
对人类健康会产生危害,为降低  的浓度,某饮用水研究人员提出用铝粉将
的浓度,某饮用水研究人员提出用铝粉将  还原为
还原为  ,其化学方程式为
,其化学方程式为  。用“双线桥法”表示反应中电子转移的方向和数目:。
。用“双线桥法”表示反应中电子转移的方向和数目:。
-
(3) 次磷酸(
 )是一种精细磷化工产品,具有较强还原性,它可将溶液中的
)是一种精细磷化工产品,具有较强还原性,它可将溶液中的  还原为银单质,因而可用于化学镀银。在利用
还原为银单质,因而可用于化学镀银。在利用  进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为(填化学式)。
进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为(填化学式)。
-
(4) 工业上常将含砷废渣(主要成分为
 ,其中硫元素显-2价)制成浆状,通入
,其中硫元素显-2价)制成浆状,通入  氧化,生成
氧化,生成  和单质硫,写出发生反应的化学方程式。
和单质硫,写出发生反应的化学方程式。
-
(5) 已知由
 、
、 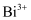 、
、  、
、  、
、  、
、  组成的一个氧化还原反应体系中,发生了
组成的一个氧化还原反应体系中,发生了  的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:++
的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:++  ++
++  。
。
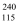 Mc的一种氧化物的化学式为
Mc的一种氧化物的化学式为 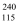 Mc2O3 , 该氧化物既有氧化性又有还原性
Mc2O3 , 该氧化物既有氧化性又有还原性



