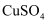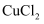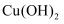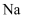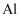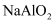钠的重要化合物 知识点题库
-
(1) NaN3是气体发生剂,受热分解产生N2和Na,N2的结构式为.
-
(2) Fe2O3是主氧化剂,与Na反应生成的还原产物为(已知该反应为置换反应),Fe2O3还可用于“铝热法”炼铁,铝热反应在冶金工业上可用于
-
(3) KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,Na2O的电子式为.
-
(4) NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为:.
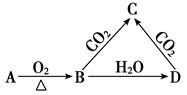
①SiO2﹣→Na2SiO3;②CuSO4﹣→CuCl2;③SiO2﹣→H2SiO3 ;④CuO﹣→Cu(OH)2;⑤Na2O2﹣→NaOH.
氧化还原反应:2FeCl3+2HI═2FeCl2+I2+2HCl;
2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI;
3I2+6KOH═5KI+KIO3+3H2O
复分解反应:2HSCN+K2CO3═2KSCN+CO2↑+H2O; KCN+CO2+H2O═HCN+KHCO3
热分解反应:4NaClO  3NaCl+NaClO4;NaClO4
3NaCl+NaClO4;NaClO4 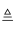 NaCl+2O2↑
NaCl+2O2↑
下列说法不正确是( )
单质 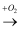 氧化物
氧化物 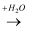 酸或碱
酸或碱 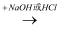 盐.
盐.
 H2SiO3
H2SiO3  Na2SiO3
B . S
Na2SiO3
B . S  SO2
SO2  BaSO3
C . CuSO4(aq)
BaSO3
C . CuSO4(aq)  Cu(OH)2
Cu(OH)2  Cu2O
D . 饱和NaCl溶液
Cu2O
D . 饱和NaCl溶液  NaHCO3
NaHCO3  Na2CO3
Na2CO3
①饱和Na2CO3溶液 ②澄清石灰水 ③NaAlO2溶液
④CaCl2溶液 ⑤Na2SiO3溶液
-
(1) 原固体混合物中 Na2CO3的物质的量:n(Na2CO3)=
-
(2) V=L.
方案Ⅰ.①称量:仪器X的质量为ag;②称量:仪器X和装有试样的质量为bg;③加热;④冷却;⑤称量:仪器X和残余物的质量为cg;⑥重复____________操作,直至恒重,质量为dg。
-
(1) 仪器X是(填名称),方案 Ⅰ 的实验原理是:(用化学方程式表示)。
-
(2) 请将步骤⑥补充完整:重复操作,步骤⑥的目的是:。
-
(3) 计算Na2CO3的质量分数要用到的数据是(选填a、b、c、d)。
-
(4) 方案Ⅱ.称量一定量样品,选用合适的装置测定样品与硫酸反应生成的气体体积。
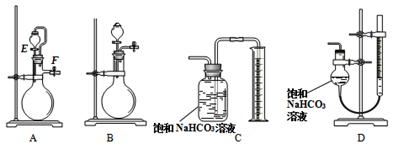
为提高测定准确性,应选用发生装置(选填“A”或“B”)和量气装置D;装置D比装置C准确性高的原因是(任一条原因)。
-
(5) 检查装置A的气密性:向A的分液漏斗中加入适量水,按图连接好装置,关闭止水夹F,打开活塞E,发现分液漏斗中的水持续滴下,说明A漏气。该判断是否正确,并说明理由:。
-
(6) 方案Ⅲ.称量0.2570g样品,置于锥形瓶中,加适量水溶解,滴2滴酚酞试液,用0.1000mol/L盐酸滴定至溶液由浅红色变成无色且半分钟不变色,反应原理:Na2CO3+HCl→NaHCO3+NaCl,重复上述操作两次。
用密度为1.19g/mL、质量分数为0.37的浓盐酸,配制1L0.1000mol/L稀盐酸,所需的定量仪器是:滴定管、1L容量瓶,其中滴定管的作用是。滴定管和容量瓶在使用前都要进行的操作是。(选填序号)
Y.检漏 Z.用蒸馏水洗涤 W.用待装液润洗
-
(7) 根据表中数据,碳酸钠的质量分数为(小数点后保留四位)。
滴定次数
样品的质量/g
稀盐酸的体积/mL
滴定前读数
滴定后读数
1
0.2570
1.00
21.01
2
0.2570
0.50
20.49
3
0.2570
1.20
21.20
-
(1) 加热时发生反应的化学方程式为。
-
(2) 所加盐酸的物质的量浓度为mol/L。
①金属钠投入MgCl2溶液中
②过量的NaOH溶液和FeCl3溶液
③碳酸氢铵加到过量的热的Ba(OH)2溶液中
④过量的Na2O2投入FeCl2溶液中
⑤过量NaOH和Ca(HCO3)2溶液混合
| 选项 | W | X | Y | Z | |
| A | | | | | |
| B | | | | | |
| C | | | | | |
| D | S | | | |
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 小苏打可用于治疗胃酸过多 | NaHCO3受热易分解 |
| B | Na2O2可作潜水艇的供氧剂 | Na2O2能和CO2、H2O反应生成O2 |
| C | 硫单质在纯氧中完全燃烧有少量SO3生成 | 二氧化硫在纯氧中易被氧化为SO3 |
| D | 氨气是电解质 | NH3的水溶液显碱性 |
-
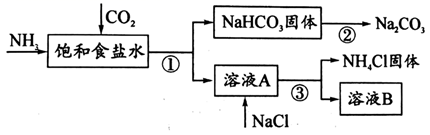
(1) ①~③所涉及的操作方法中,包含过滤的是 (填序号)。
-
(2) 根据上图,将化学方程式补充完整: NH3 + CO2 ++ = NaHCO3↓+ NH4Cl
-
(3) 煅烧NaHCO3固体的化学方程式是。
-
(4) 下列说法中,正确的是_____ (填字母)。A . CO2可循环使用 B . NH4Cl副产物可用作肥料 C . 溶液B中一定含有Na+、NH
 、Cl-
、Cl-
-
(5) 同学们将Na2CO3和NaHCO3固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案
预测现象
预测依据
操作1:向2 mLNa2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
有白色沉淀
Na2CO3溶液中的CO
 浓度较大,能与CaCl2发生反应(写离子方程式)
浓度较大,能与CaCl2发生反应(写离子方程式)操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
无白色沉淀
NaHCO3溶液中的CO
 浓度很小,不能与CaCl2反应
浓度很小,不能与CaCl2反应