氯离子的检验 知识点题库
下列说法中正确的是( )
A . Cl-和Cl2都有毒
B . 将AgNO3溶液滴入某溶液中,若出现沉淀,则说明溶液中含有Cl-
C . 将NaCl溶液滴入AgNO3溶液中或将氯气通入AgNO3溶液中均会出现白色沉淀
D . 含Cl-的溶液和氯水一样均呈黄绿色
在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸.市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售.为辨别真伪,可用下列哪一种试剂来鉴别( )
A . 酚酞试液
B . 氯化钡溶液
C . 氢氧化钠溶液
D . 硝酸银溶液
自来水是用氯气杀菌消毒的,不法商贩用自来水冒充纯净水出售,为辨别真伪,可用下列哪种试剂鉴别( )
A . 酚酞溶液
B . FeCl3溶液
C . AgNO3溶液
D . NaOH溶液
“家庭小实验”是指利用家庭生活用品来进行的简单化学实验,下列实验不能称为“家庭小实验”的是( )
A . CO2不能支持蜡烛燃烧
B . 检验自来水是否含有氯离子
C . 除去热水瓶中的水垢
D . 鉴别是羊毛织物的材质
为了检验溶液中是否有Cl﹣存在,最好选用下列物质中的( )
A . 硝酸银溶液
B . 四氯化碳
C . 氢氧化钠溶液
D . 硝酸酸化的硝酸银溶液
Cl2是一种重要的化工原料,下图是一些含氯产品.
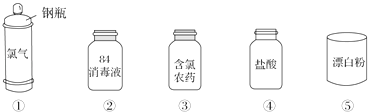
-
(1) ①中钢瓶上应贴的标签为 .A . 腐蚀品 B . 爆炸品 C . 有毒品 D . 易燃品
-
(2) 下列有关漂白粉和漂白液的说法正确的是 .A . 漂白粉是纯净物,漂白液是混合物 B . 漂白粉的有效成分是Ca(ClO)2 C . 工业上将氯气通入澄清石灰水制取漂白粉 D . 漂白液的有效成分是Na2O2
-
(3) 工业上利用Cl2制盐酸,其化学方程式为.Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是.
A.硝酸银溶液 B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
-
(4) 将8.7g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是 L;被氧化的HCl的质量是 g.
下列检验或鉴别方法正确的是( )
A . 用澄清的石灰水鉴别Na2CO3和NaHCO3这两种溶液
B . 向溶液中滴加硝酸酸化的Ba(NO3)2溶液检验SO42-
C . 先加稀硝酸酸化,再滴入AgNO3溶液检验溶液中的Cl-
D . 加入氢氧化钠溶液,将湿润的红色石蕊试纸放在试管口不变蓝,证明无NH4+
某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是 ( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A . ①②④②③
B . ④②①②③
C . ①②③②④
D . ④②③②①
检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A . 向未知溶液中加入AgNO3溶液,有白色沉淀产生
B . 向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C . 向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D . 向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
下列有关实验说法,错误的是( )
A . 苯酚不慎沾到皮肤上,应立即用酒精洗涤,再用大量水冲洗
B . KCl和MnO2的混合物经溶解、过滤、洗涤、干燥,可分离出MnO2
C . 用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D . 火柴头的浸泡液中滴加AgNO3溶液、稀HNO3和NaNO2溶液,可检验火柴头是否含有氯元素
下列离子检验操作、结论均合理的是( )
A . 用AgNO3溶液检验Cl-时,先加入适量稀盐酸以排除CO32-干扰
B . 某溶液中滴加KSCN溶液呈红色,说明不含Fe2+
C . 某溶液中滴加氯水后再滴加KSCN溶液呈红色,说明原溶液含有Fe3+
D . 某无色溶液中滴加氯水后溶液呈棕色,再滴加淀粉溶液显蓝色,说明原溶液中含有I-
溶液中常见离子的检验及结论正确的是( )
A . 若加入淀粉溶液,溶液显蓝色,则一定有Iˉ
B . 若加入AgNO3溶液有白色沉淀产生,则一定有Clˉ
C . 若加入Ba(NO3)2溶液,有白色沉淀产生,则一定有SO  D . 若加入NaOH溶液,微热,产生使润湿红色石蕊试纸变蓝的气体,则一定有NH
D . 若加入NaOH溶液,微热,产生使润湿红色石蕊试纸变蓝的气体,则一定有NH 
 D . 若加入NaOH溶液,微热,产生使润湿红色石蕊试纸变蓝的气体,则一定有NH
D . 若加入NaOH溶液,微热,产生使润湿红色石蕊试纸变蓝的气体,则一定有NH 
水合肼(N2H4•H2O)常用作航天器燃料,也广泛应用于医药生产。实验室制取水合肼,并模拟处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如图:

-
(1) 反应Ⅰ中温度升高时易产生副产物NaClO3。为提高NaClO产率,实验中可采取的措施有___A . 反应容器浸入热水中 B . 适当减慢通入Cl2的速率 C . 不断搅拌溶液
-
(2) ①NaClO与CO(NH2)2反应合成水合肼的离子方程式为。
②合成过程中需控制
 ≈
≈  ,比理论值
,比理论值  略大的原因是。
略大的原因是。 -
(3) 检验分离出水合肼后的溶液中Cl-的实验操作是。
-
(4) 铜粉沉淀率与水合肼溶液浓度的关系如图所示。请设计由铜氨废液回收铜粉的实验方案:取一定量5mol•L-1水合肼溶液,,静置、过滤、洗涤、干燥。
实验中可选用的试剂:5mol•L-1水合肼溶液、2mol•L-1硫酸、2mol•L-1NaOH溶液、铜氨废液、蒸馏水。
已知:2[Cu(NH3)4]2++N2H4•H2O+4OH-
 2Cu↓+N2↑+8NH3↑+5H2O。
2Cu↓+N2↑+8NH3↑+5H2O。
下列关于化学与职业的表述错误的是( )
A . 水质检验员在自来水出厂前会对水中的  、Cl-、微生物、有机物等进行检测和分析
B . 化学科研工作者可从事特定功能新分子合成、节能环保物质转化工艺的研发等
C . 科技考古研究人员是靠文献记载、年历学和各种有纪年文字的遗物来断定文物的绝对年代
D . 测试工程师可通过化学检测仪或化学检测方法测出不锈钢中的某些组成元素及其含量来确定不锈钢的等级
、Cl-、微生物、有机物等进行检测和分析
B . 化学科研工作者可从事特定功能新分子合成、节能环保物质转化工艺的研发等
C . 科技考古研究人员是靠文献记载、年历学和各种有纪年文字的遗物来断定文物的绝对年代
D . 测试工程师可通过化学检测仪或化学检测方法测出不锈钢中的某些组成元素及其含量来确定不锈钢的等级
 、Cl-、微生物、有机物等进行检测和分析
B . 化学科研工作者可从事特定功能新分子合成、节能环保物质转化工艺的研发等
C . 科技考古研究人员是靠文献记载、年历学和各种有纪年文字的遗物来断定文物的绝对年代
D . 测试工程师可通过化学检测仪或化学检测方法测出不锈钢中的某些组成元素及其含量来确定不锈钢的等级
、Cl-、微生物、有机物等进行检测和分析
B . 化学科研工作者可从事特定功能新分子合成、节能环保物质转化工艺的研发等
C . 科技考古研究人员是靠文献记载、年历学和各种有纪年文字的遗物来断定文物的绝对年代
D . 测试工程师可通过化学检测仪或化学检测方法测出不锈钢中的某些组成元素及其含量来确定不锈钢的等级
已知实验室制备氯气的化学反应原理:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
MnCl2+Cl2↑+2H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
 MnCl2+Cl2↑+2H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
MnCl2+Cl2↑+2H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。 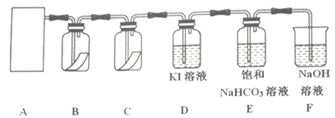
请回答下列问题:
-
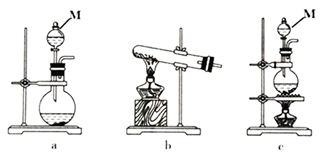
(1) 该实验中,在A处用于制取氯气的实验装置是(填字母),仪器M的名称为。
-
(2) 装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的红色布条也褪色,其原因可能是,请提出合理的改进方法。
-
(3) 写出装置D溶液中反应的离子方程式:。
-
(4) 氯气通入饱和NaHCO3溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明Cl2与H2O反应的产物中含有(填化学式)。
-
(5) 装置F的作用是,用化学方程式表示其反应原理:,验证反应后装置F的溶液中是否存在Cl-的正确操作是。
水质检验员是指对各类水样进行检验的专业技术人员。在处理某处污水处理厂的水样时,水质检验员取适量被检测的溶液于试管中,滴加适量的稀HNO3酸化,再滴入几滴AgNO3溶液,如产生白色沉淀,则判断该溶液中含有( )
A .  B . Ca2+
C .
B . Ca2+
C .  D . Cl-
D . Cl-
 B . Ca2+
C .
B . Ca2+
C .  D . Cl-
D . Cl-
为检验溶液里的某种离子,进行下列实验,其中结论正确的是( )
A . 溶液中加 AgNO3 溶液有白色沉淀生成,再加入稀盐酸沉淀不溶解,溶液一定含 Cl-
B . 先滴加 KSCN 溶液不显红色,再滴加氯水后显红色证明某溶液中含有 Fe2-
C . 某溶液进行焰色反应为黄色,则该溶液一定含有 Na+ ,一定没有K+
D . 溶液中加入稀 HCl,产生使澄清石灰水变浑浊的无色气体,则溶液中一定含 CO32-
下列方案设计、现象和结论都正确的是( )
目的 | 方案设计 | 现象和结论 | |
A | 验证NaCl、Na2SO4、NaOH混合溶液中的Cl- | 取混合溶液于试管中,加入过量的Ba(NO3)2溶液充分反应,静置,向上清液中滴加AgNO3溶液 | 若上清液变浑浊。则混合溶液中含有Cl- |
B | 证明氧化性:Cl2>Fe3+> | 向2支盛有FeCl2溶液的试管中分别加入氯水。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液相BaCl2溶液 | 第一支试管中溶液变成血红色, 第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+> |
C | 证明CH4和Cl2光照下发生取代反应 | 将装有干燥Cl2的集气瓶倒扣在装有干燥CH4的集气瓶上,抽出玻璃片,置于光照条件下反应 | 观察到集气瓶内出现白雾,则证明CH4与Cl2发生了取代反应 |
D | 探究AgCl和AgI的溶解度的大小 | 向2支盛有2mL相同浓度硝酸银溶液的试管中分别加入相同滴数同浓度的NaCl和NaI溶液 | 若一支试管中无明显现象,另一支试管中产生黄色沉淀,则AgCl溶解度大于AgI |
A . A
B . B
C . C
D . D
下列有关离子(或物质)的检验及结论正确的是( )
A . 无色溶液加入 溶液,用湿润的红色石蕊试纸放试管口未变蓝,则原溶液中无
溶液,用湿润的红色石蕊试纸放试管口未变蓝,则原溶液中无 B . 向无色溶液中加入
B . 向无色溶液中加入 溶液有白色沉淀出现,则溶液中一定含有
溶液有白色沉淀出现,则溶液中一定含有 C . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定是钠盐
D . 向某溶液中加入稀盐酸产生使澄清石灰水变浑浊的气体,则溶液中可能含有
C . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定是钠盐
D . 向某溶液中加入稀盐酸产生使澄清石灰水变浑浊的气体,则溶液中可能含有
 溶液,用湿润的红色石蕊试纸放试管口未变蓝,则原溶液中无
溶液,用湿润的红色石蕊试纸放试管口未变蓝,则原溶液中无 B . 向无色溶液中加入
B . 向无色溶液中加入 溶液有白色沉淀出现,则溶液中一定含有
溶液有白色沉淀出现,则溶液中一定含有 C . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定是钠盐
D . 向某溶液中加入稀盐酸产生使澄清石灰水变浑浊的气体,则溶液中可能含有
C . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定是钠盐
D . 向某溶液中加入稀盐酸产生使澄清石灰水变浑浊的气体,则溶液中可能含有
离子反应在物质分离、提纯、鉴定等方面有广泛的应用。实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。

已知:操作①中发生的化学反应方程式为: ;操作②和③中,试剂1是
;操作②和③中,试剂1是 溶液,试剂2是
溶液,试剂2是 溶液,且二者均过量。
溶液,且二者均过量。
-
(1) 写出
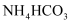 在水溶液中的电离方程式:;
在水溶液中的电离方程式:;
-
(2) 加入试剂1发生时反应的离子方程式:;
-
(3) 试剂2的目的是;
-
(4) 如何检验NaCl溶液产品中的
 ?
?
最近更新




