铁的化学性质 知识点题库
在硫酸亚铁、硫酸铁和硫酸铜溶液中加入铁粉,充分反应后,滤出的不溶物除铜粉外,尚有少量铁粉,那么在滤液中( )
A . 肯定有Fe2+ , 可能有Fe3+
B . 只有Fe2+ , 没有Fe3+和Cu2+
C . 可能有Fe3+ , 可能有Cu2+
D . 肯定有Fe2+ , 可能有Fe3+、Cu2+
下列有关说法中不正确的是( )
A . 铁与Cl2、盐酸均能发生反应,但生成的含铁物质组成不同
B . 分别加热蒸干并灼烧铁、铝的氯化物溶液,最后得到的物质均为金属氧化物
C . 等物质的量的Na、Cu、Al与足量氯气反应时,消耗的氯气一样多
D . 常温下,铁片、铝片与浓硫酸的反应均只能停留在金属的表面上
下列化合物能由单质直接化合生成的是( )
A . NO2
B . FeCl3
C . SO3
D . FeCl2
下列实验方案可行的是( )
A . 用浓硫酸干燥氨气
B . 用酚酞试液检验酸性溶液
C . 通入Cl2除去FeCl3溶液中的FeCl2
D . 加入Fe粉除去Al3+溶液中的杂质Cu2+
部分金属可以与水在一定条件下发生反应.
-
(1) 将一小块金属钠投入盛有水的烧杯中,待完全反应后,向其中滴加酚酞溶液.
①钠与水反应的化学方程式是.
②上述实验过程中,可观察到的实验现象有(填选项序号),产生现象b的原因是.
a.钠浮在水面
b.钠熔成小球
c.钠球在水面上四处游动,发出嘶嘶声,逐渐消失
d.反应后向烧杯中滴加酚酞溶液,溶液呈红色
-
(2) 铁粉可以与水蒸气在高温下反应,生成 (填化学式)和氢气.
同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律.已知氧化性:Fe3+>Cu2+ , 在溶有Fe2(SO4)3和CuSO4的溶液中加入铁粉,下列说法中不正确的是( )
A . 若铁粉有剩余,则不溶物中一定有铜
B . 若铁粉有剩余,则溶液中的金属阳离子只有Fe2+
C . 若铁粉无剩余,且溶液中有Cu2+ , 则溶液中一定无Fe3+
D . 若铁粉无剩余,且溶液中无Cu2+ , 则溶液中一定有Fe2+ , 一定无Fe3+
下列金属最易与H2O发生反应的是( )
A . Na
B . K
C . Al
D . Mg
下列物质反应后的溶液中加入KSCN溶液一定会变红色的( )
A . Fe2O3与HCl反应
B . 过量铁粉与稀硝酸反应
C . 少量铁粉与稀盐酸作用
D . 铁粉与CuSO4反应
下列反应不能通过一步反应实现的是( )
A . SiO2→H2SiO3
B . Cu→CuSO4
C . Fe→FeCl2
D . Al→Na[Al(OH)4]
已知一定条件下A,B,C,D之间的转化关系如右图所示。下列说法正确的是( )

A . 若A为Fe,D为氢气,则B一定为酸
B . 若A,D为化合物,B为水,则C一定是气体单质
C . 若A,B,C,D均为化合物,该反应一定属于复分解反应
D . 若A,B,C,D均为10电子微粒(分子或离子),且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
Fe与下列物质反应的产物,能使KSCN溶液显红色的是( )
A . H2O
B . O2
C . S
D . 足量稀HNO3
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
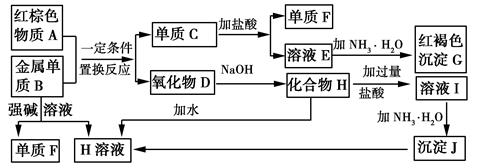
请回答下列问题:
-
(1) 物质A的化学式为。
-
(2) 写出单质B与强碱溶液反应的离子方程式,氧化物D与NaOH溶液反应的化学方程式。
-
(3) 溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
-
(4) 溶液E敞口放置容易变质,写出检验溶液E是否变质的实验操作、现象及结论,为了防止溶液E的变质,可往溶液中加入。
-
(5) 溶液I中所含金属离子是。
为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是( )
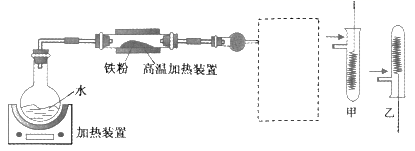
A . 高温加热装置中发生的反应为3Fe(s)+4H2O(g)  Fe3O4(s)+4H2(g)
B . 虚线框处宜选择的装置是甲
C . 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D . 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
Fe3O4(s)+4H2(g)
B . 虚线框处宜选择的装置是甲
C . 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D . 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
 Fe3O4(s)+4H2(g)
B . 虚线框处宜选择的装置是甲
C . 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D . 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
Fe3O4(s)+4H2(g)
B . 虚线框处宜选择的装置是甲
C . 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D . 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
反应条件会影响化学反应产物或现象。下列有关影响因素的分析错误的是( )
| 选项 | 反应物 | 反应产物或现象 | 影响因素 |
| A | C2H5OH、浓硫酸 | C2H4 或乙醚 | 温度 |
| B | Na、O2 | Na2O 或 Na2O2 | O2 用量 |
| C | Fe、H2SO4 | 有 H2或无 H2 | H2SO4的浓度 |
| D | 氯化铝溶液、氢氧化钠溶液 | 现象不同 | 试剂滴加顺序 |
A . A
B . B
C . C
D . D
给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
化学与社会、生产,生活密切相关,下列说法正确的是( )
A . 宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是氢氧化铜
B . 我国全面启动的北斗导航系统的信号与晶体硅有关
C . 当液氨罐泄漏时,人们应该向高处躲避,将其移入水塘中,并向水塘中加入熟石灰
D . 月饼包装袋中常放入小袋的黑色粉末,目的是防止食品氧化变质
已知甲、乙、丙、丁是四种常见物质,其转化关系如图所示。

请回答下列问题:
-
(1) 若丁为O2 , 乙常温下为淡黄色单质固体。写出乙中所含元素在周期表中的位置,甲的分子式。
-
(2) 若丙和丁均为金属单质,且丙为我国目前生产量最大,使用最广泛的金属,甲和乙均为盐溶液。比较丙和丁还原性强弱:丙丁(写>、<、=),甲跟丙反应生成乙的离子方程式。
-
(3) 若甲、乙、丙的水溶液均呈碱性且丙可制胃药。写出甲和丙反应生成乙的化学方程式。
2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
-
(1) CO2甲烷化反应是由法国化学家PaulSabatier提出的。CO2催化氢化制甲烷的研究过程如图所示:

①上述过程中,产生H2反应的化学方程式为。
②HCOOH是CO2转化为CH4的中间体:CO2
 HCOOH
HCOOH  CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少。当增加镍粉用量时,CO2镍催化氢化制甲烷的两步发应中反应速率增加较大的一步是(填“I”或“II”)。
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少。当增加镍粉用量时,CO2镍催化氢化制甲烷的两步发应中反应速率增加较大的一步是(填“I”或“II”)。 -
(2) CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)反应II:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)在1L恒容密闭容器中充入1molCO2和4molH2 , 测得平衡时有关物质的物质的量随温度变化如图所示。

T1℃时,CO2的转化率为。T1℃时,反应I的平衡常数K=。
-
(3) 已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g)△H<0。m代表起始时的投料比,即m=
C2H5OH(g)+3H2O(g)△H<0。m代表起始时的投料比,即m=  。m=3时,该反应达到平衡状态后p(总)=20aMPa,恒压条件下各物质的物质的量分数与温度的关系如图。T4温度时,反应达到平衡时物质d的分压p(d)=。
。m=3时,该反应达到平衡状态后p(总)=20aMPa,恒压条件下各物质的物质的量分数与温度的关系如图。T4温度时,反应达到平衡时物质d的分压p(d)=。 
用硫铁矿烧渣(主要成分为Fe2O3和少量SiO2)为原料制取绿矾(FeSO4·7H2O),同时对绿矾在高温下的分解产物进行实验探究。
-
(1) Ⅰ.绿矾制备流程如下:
 滤渣的主要化学成分是(填化学式)。
滤渣的主要化学成分是(填化学式)。 -
(2) 操作①、②、③是同一分离操作,该操作名称为。
-
(3) 向溶液X中加入过量的铁粉,发生的主要反应的离子方程式为。
-
(4) 若用含90%氧化铁的硫铁矿烧渣100 t,制得278 t绿矾,该工艺生产绿矾的产率为(保留三位有效数字,产率
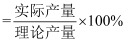 )。
)。
-
(5) Ⅱ.绿矾在高温下的分解产物实验探究
绿矾在加热至高温时会分解,为确定分解产物(已知产物中有SO3气体生成),设计如下实验装置进行了探究:

仪器G的名称为。
-
(6) 加热前,先通入一段时间氮气的目的是。
-
(7) 观察到的现象:玻璃直管中有红棕色的固体生成,B中白色固体变蓝,C中溶液褪色,请根据实验现象写出绿矾高温分解的化学方程式。
人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的铁粉,这些铁粉在人体胃酸(主要成分是HCl)作用下转化成亚铁盐。下列叙述不正确的是( )
A . 铁粉具有还原性
B . 铁是人体必需的微量元素
C . 亚铁盐溶液呈浅绿色
D . Fe+2H+=Fe3++H2↑
最近更新



