镁的化学性质 知识点题库
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A . 2mol/L﹣1 H2SO4 溶液
B . 18mol/L﹣1 H2SO4溶液
C . 6mol/L﹣1 KOH 溶液
D . 3mol/L﹣1 HNO3溶液
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
A . [Al (OH)4]﹣
B . Cu2+
C . Al3+
D . Mg2+
下列实验中,不能观察到明显变化的是( )
A . 把一段打磨过的镁带放入少量冷水中
B . 把Cl2通入FeCl2溶液中
C . 把绿豆大的钾投入到水中
D . 把溴水滴加到KI淀粉溶液中
镁铝性质相似,下表中对两者的对比不正确的是( )
选项 | 反应 | 铝 | 镁 |
A | 与非金属 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
B | 与水 | 能与沸水反应 | 反应很困难 |
C | 与碱 | 能溶于强碱溶液 | 不反应 |
D | 与某些氧化物 | 能与Fe2O3、MnO2、Cr2O3等 金属氧化物发生铝热反应 | 能在CO2中燃烧 |
A . A
B . B
C . C
D . D
Mg和Al都是较活泼的金属,下列说法正确的是( )
A . Mg+2RbCl  MgCl2+2Rb.所以镁的金属活动性比铷强
B . 在由镁铝形成的原电池中,负极反应一定是:Mg﹣2e﹣═Mg2+
C . MgCl2、AlCl3溶液分别加热蒸发、灼烧,均可得到氧化镁和氧化铝
D . 因为氧化镁和氧化铝都是高熔点的物质,所以工业上分别用电解熔融MgCl2和AlCl3的方法制取镁和铝
MgCl2+2Rb.所以镁的金属活动性比铷强
B . 在由镁铝形成的原电池中,负极反应一定是:Mg﹣2e﹣═Mg2+
C . MgCl2、AlCl3溶液分别加热蒸发、灼烧,均可得到氧化镁和氧化铝
D . 因为氧化镁和氧化铝都是高熔点的物质,所以工业上分别用电解熔融MgCl2和AlCl3的方法制取镁和铝
 MgCl2+2Rb.所以镁的金属活动性比铷强
B . 在由镁铝形成的原电池中,负极反应一定是:Mg﹣2e﹣═Mg2+
C . MgCl2、AlCl3溶液分别加热蒸发、灼烧,均可得到氧化镁和氧化铝
D . 因为氧化镁和氧化铝都是高熔点的物质,所以工业上分别用电解熔融MgCl2和AlCl3的方法制取镁和铝
MgCl2+2Rb.所以镁的金属活动性比铷强
B . 在由镁铝形成的原电池中,负极反应一定是:Mg﹣2e﹣═Mg2+
C . MgCl2、AlCl3溶液分别加热蒸发、灼烧,均可得到氧化镁和氧化铝
D . 因为氧化镁和氧化铝都是高熔点的物质,所以工业上分别用电解熔融MgCl2和AlCl3的方法制取镁和铝
下列物质能跟镁粉反应,并有氢气放出的是( )
①醋酸溶液 ②福尔马林
③葡萄糖粉末共热 ④乙醚.
A . ①、②
B . ①、④
C . ①、③
D . ②、④
甲、乙、丙之间具有如图所示的转化关系.则甲不可能是( )
甲  乙
乙  丙.
丙.
A . N2
B . C
C . Mg
D . Na
下列通过实验观察得到的结论正确的是( )
选项 | 实验操作 | 结论 |
A | AlCl3溶液中逐滴滴加NaOH溶液至过量 | Al(OH)3能溶于强碱溶液 |
B | 铝、镁分别投入相同浓度的NaOH溶液 | 铝比镁更活泼 |
C | 铝箔用酒精灯加热至熔化,轻轻晃动 | 铝单质熔点高 |
D | 铁粉与水蒸气反应后固体加稀HCl溶解,再加KSCN溶液,溶液不变红 | 反应后固体中不含+3价的铁 |
A . A
B . B
C . C
D . D
把一支试管放在盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5 mL盐酸,回答下列问题:

-
(1) 实验中观察到的现象是。
-
(2) 产生上述现象的原因是。
-
(3) 写出有关反应的离子方程式。
在一定条件下不能与金属镁反应的物质是
A . 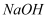 溶液
B .
溶液
B . 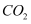 C .
C .  D . 稀盐酸
D . 稀盐酸
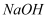 溶液
B .
溶液
B . 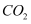 C .
C .  D . 稀盐酸
D . 稀盐酸
将钠、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是()
A . 1∶2∶3
B . 6∶3∶2
C . 3∶1∶1
D . 1∶1∶1
下列方程式不正确的是( )
A . 镁在二氧化碳中燃烧的化学方程式:2Mg+CO2  2MgO+C
B . 一水合氨在水中的电离方程式:NH3·H2O=NH
2MgO+C
B . 一水合氨在水中的电离方程式:NH3·H2O=NH  +OH-
C . 氯化铁水解的离子方程式:Fe3++3H2O
+OH-
C . 氯化铁水解的离子方程式:Fe3++3H2O  Fe(OH)3+3H+
D . 乙醇在铜催化下被氧化的化学方程式:2CH3CH2OH+O2
Fe(OH)3+3H+
D . 乙醇在铜催化下被氧化的化学方程式:2CH3CH2OH+O2  2CH3CHO+2H2O
2CH3CHO+2H2O
 2MgO+C
B . 一水合氨在水中的电离方程式:NH3·H2O=NH
2MgO+C
B . 一水合氨在水中的电离方程式:NH3·H2O=NH  +OH-
C . 氯化铁水解的离子方程式:Fe3++3H2O
+OH-
C . 氯化铁水解的离子方程式:Fe3++3H2O  Fe(OH)3+3H+
D . 乙醇在铜催化下被氧化的化学方程式:2CH3CH2OH+O2
Fe(OH)3+3H+
D . 乙醇在铜催化下被氧化的化学方程式:2CH3CH2OH+O2  2CH3CHO+2H2O
2CH3CHO+2H2O
下列有关化学反应的叙述正确的是( )
A . 电解熔融MgCl2生成Mg(OH)2
B . 加热NH4Cl制备NH3
C . 室温下,Al和Fe2O3反应生成Fe
D . 铜和浓硝酸反应生成NO2
按要求填空:
-
(1) 单质铝和氢氧化钾溶液反应的化学方程式:。
-
(2) 单质镁与二氧化碳反应的化学方程式:。
-
(3) 工业制备粗硅的化学方程式:。
-
(4) 氨的催化氧化反应:。
-
(5) 实验室制氯气的离子方程式:。
-
(6) 硫代硫酸钠与盐酸反应的离子方程式:。
对下列实验现象及其解释错误的是( )
A . 金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致
B . 把烧红的铁丝放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色
C . 单质Mg、Al与O2反应,条件不同,可能产生不同的产物
D . 镁带在空气中点燃发出耀眼光芒,常用于制照明弹,主要发生反应:2Mg+O2  2MgO,其中,Mg作还原剂
2MgO,其中,Mg作还原剂
 2MgO,其中,Mg作还原剂
2MgO,其中,Mg作还原剂
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。
-
(1) 铝原子核外有种不同运动状态的电子,最外层电子的轨道表示式为。
-
(2) 铍与铝性质相似。将BeCl2溶液加热蒸干后灼烧,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的分子式为。写出BeCl2溶液和过量氨水反应的离子方程式:。
-
(3) 取适量Al-Mg合金样品置于烧杯中,加入20mL1mol/L的NaOH溶液,恰好完全反应。下列叙述正确的是。
a.上述反应可视为原电池反应,此时Mg作负极,Al作正极
b.若加入的是20mL1mol/L的盐酸,则放出的氢气的物质的量减少

c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2
-
(4) 用铝和金属氧化物反应制备单质是工业上较常用的方法。如:2Al+4BaO
 3Ba↑+BaO•Al2O3。常温下Al的金属性比Ba的金属性(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是。
3Ba↑+BaO•Al2O3。常温下Al的金属性比Ba的金属性(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是。 a.高温时,Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时,BaO∙Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
-
(5) 氮化铝是一种既有前途的电子绝缘基片材料,它化学稳定性好,耐高温、酸、碱,抗冲击能力强。可通过下列反应制备:Al2O3+3C+N2→2AlN+3CO+Q(Q<0)。上述反应物与生成物中,属于非极性分子的电子式为;构成AlN的微粒是。
-
(6) 下列选项能判断氮、氧元素非金属性强弱的是。
a.气态氢化物的沸点
b.单质与氢气化合的难易程度
c.最高价氧化物对应水化物的酸性
d.NO中O显-2价,N显+2价
下列说法错误的是( )
A . SO2使品红、溴水褪色的原因是它有漂白性
B . Mg着火不能用泡沫灭火器灭火
C . Al(OH)3胶体具有很强的吸附性,可以用来净水
D . 新制Cu(OH)2悬浊液可用来检验牙膏中甘油的存在
下列说法正确的是( )
A . 常温下浓硫酸与铁或铝均不反应
B . 高温下用氢气还原四氯化硅可得到硅
C . Mg条在空气中燃烧主要生成Mg3N2
D . Cl2常用澄清石灰水吸收避免污染空气
在给定条件下,下列选项所示的物质转化均能实现的是( )
A . S  SO2
SO2  CaSO4
B . 粗Si
CaSO4
B . 粗Si 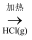 SiHCl3
SiHCl3  纯Si
C . Mg
纯Si
C . Mg  Mg3N2
Mg3N2  MgO
D . N2
MgO
D . N2  NH3
NH3 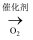 NO
NO  HNO3
HNO3
 SO2
SO2  CaSO4
B . 粗Si
CaSO4
B . 粗Si 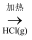 SiHCl3
SiHCl3  纯Si
C . Mg
纯Si
C . Mg  Mg3N2
Mg3N2  MgO
D . N2
MgO
D . N2  NH3
NH3 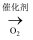 NO
NO  HNO3
HNO3
下列说法错误的是( )
A . 硫酸钡可用作白色颜料,并可用作医疗上检查肠胃的钡餐
B . 钠钾合金在常温下是液体,可用于快中子反应堆作热交换剂
C . 工业上可用氨水消除燃煤烟气中的二氧化硫
D . 镁是优质的耐高温材料,被大量用于制造火箭、导弹和飞机的部件等
最近更新



