抚州市高一化学上册期末考试刷题训练
| 1. 选择题 | 详细信息 |
|
下列有关金属及其化合物用途的说法不正确的是( ) A.氢氧化铝可作胃酸的中和剂 B.明矾用作净水剂 C.铝罐可久盛食醋 D.制饭勺、饭盒、高压锅等的不锈钢是合金 |
|
| 2. 选择题 | 详细信息 |
|
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用Na2SeO3清除人体内活性氧,Na2SeO3的作用是( ) A.还原剂 B.氧化剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂 |
|
| 3. 选择题 | 详细信息 |
|
下列实验操作正确或能达到目的的是( ) A. 托盘上各放一张滤纸,然后在右盘上添加2g砝码,称取2.0gNaOH固体 B. 因为碘易溶于CCl4,所以常用CCl4萃取碘水中的碘 C. 向沸水中边滴加FeCl3溶液边用玻璃棒搅拌,可制得Fe(OH)3胶体 D. 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液。 |
|
| 4. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法中正确的是 A.物质的量浓度为 0.5 mol·L-1 的 MgCl2溶液中,含有 Cl-个数为 NA B.18gNH4+所含电子数为11NA C.标准状况下,22.4 L氦气与22.4 L氯气所含原子数均为2NA D.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
|
| 5. 选择题 | 详细信息 |
|
乙醚是一种吸入性麻醉剂,熔点为-116.3℃,沸点为 34.6 ℃,微溶于水,易溶于乙醇。要从乙醇与乙醚的混合物中分离出乙醇,需要用到的仪器是 A. C. 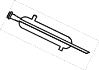 D. D. |
|
| 6. 选择题 | 详细信息 |
|
下列离子组能在溶液中大量共存是 A.Na+、Ba2+、Cl-、CO32- B.Mg2+、NH4+、Cl-、SO42- C.Fe2+、H+、SO42-、NO3- D.K+、Fe3+、NO3-、SCN- |
|
| 7. 选择题 | 详细信息 |
图表示质量相同的气体 X和 N2 在相同容积的密闭容器中压强(p)与温度(T)的关系,则气体 X可能是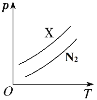 A.NH3 B.O2 C.CO D.CO2 |
|
| 8. 选择题 | 详细信息 |
|
下列实验操作及装置正确的是 A.配制一定物质的量浓度的 NaOH溶液 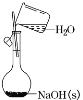 B.比较 NaHCO3和 Na2 CO3 的热稳定性 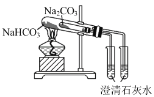 C.制取并观察 Fe(OH)2沉淀 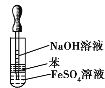 D.蒸馏海水 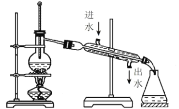 |
|
| 9. 选择题 | 详细信息 |
|
下列离子方程式的书写正确的是( ) A.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O B.向澄清石灰水中通入过量CO2:CO2+ OH-=HCO3- C.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O D.氯化铝溶液与过量的氨水反应:Al3+4NH3·H2O=AlO2-+4NH4++2H2O |
|
| 10. 选择题 | 详细信息 |
|
食盐中的碘以碘酸钾(KIO3)形式存在,可根据反应:IO3-+5I-+6H+═ 3I2+3H2O验证食盐中存在IO3-。根据上述反应,下列说法正确的是 A.IO3- 得电子,被氧化 B.I2 是氧化产物,H2O 是还原产物 C.该条件下还原性:I- > I2 D.每生成 3 mol I2,转移电子的物质的量为 6 mol |
|
| 11. 选择题 | 详细信息 | |||||||||||||||
下列“实验结论”与“实验操作及现象”相符的一组是
|
||||||||||||||||
| 12. 选择题 | 详细信息 |
某学校实验室从化学试剂商店买回的盐酸试剂上的标签如图所示。下列说法正确的是 A.从试剂瓶中取出100 mL该盐酸,在空气中久置,溶液质量将增大 B.1 mol Fe与足量该酸反应产生22.4 L氢气 C.配制250 mL 6 mol · L-1稀盐酸需取该浓盐酸100 mL D.该溶液溶质的物质的量浓度约为12 mol · L-1 |
|
| 13. 选择题 | 详细信息 |
|
用浓盐酸配制 100 mL 0.10 mol·L-1 的稀盐酸溶液时,下列实验操作会使配得的溶液浓度偏大的是 A.量筒用蒸馏水洗净后未干燥就用来量取浓盐酸 B.移液前容量瓶中有少量的蒸馏水 C.在容量瓶中进行定容时俯视读数 D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
|
| 14. 选择题 | 详细信息 |
|
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是 A. NaAlO2和H2SO4 B. AlCl3和NaOH C. NaHSO4和Ba(OH)2 D. Na2CO3和H2SO4 |
|
| 15. 选择题 | 详细信息 |
|
金属铜的提炼多从黄铜矿开始。黄铜矿在焙烧过程中主要反应之一的化学方程式为: 2CuFeS2 + O2 = Cu2S + 2FeS + SO2,下列说法不正确的是 A.O2只做氧化剂 B.CuFeS2既是氧化剂又是还原剂 C.SO2既是氧化产物又是还原产物 D.若有1 mol O2参加反应,则反应中共有4 mol电子转移 |
|
| 16. 选择题 | 详细信息 |
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )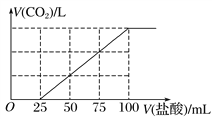 A. 原NaOH溶液的浓度为0.2 mol·L-1 B. 通入CO2在标准状况下的体积为448 mL C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3 D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1 |
|
| 17. 综合题 | 详细信息 |
|
饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。 (1)①配平方程式: Al+ NO3-+ OH-+ = [Al(OH)4]-+ N2↑。__________ ②上述反应中,还原剂与还原产物的物质的量之比是______,反应中转移电子0.3mol,生成_________mL N2(标准状况下)。 (2)①已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为________________。 ②Na2S2O3具有较强还原性,能作为织锦物漂白后的脱氯剂,脱氯后S2O32-转变为SO42-。现需处理含标准状况下Cl2 2.24L的织锦物,理论上需要0.1mol/L Na2S2O3溶液的体积为______mL。 |
|
| 18. 综合题 | 详细信息 |
|
铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题: (1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。 A.纯铁硬度比生铁高 B.纯铁耐腐蚀性强,不易生锈 C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应 (2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式为____________________________________。 (3)酸性条件下Fe2+与双氧水反应的离子方程式为__________________________________。 (4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。 ①已知MnSO4在反应中失去电子,则该反应的氧化剂是________; ②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为__________; ③写出该反应的化学方程式______________________________________________________。 |
|
| 19. | 详细信息 |
明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。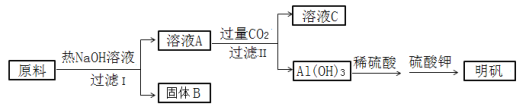 回答下列问题: (1)KAl(SO4)2的电离方程式______________________________。 (2)原料溶解过程中反应的离子方程式是___________________________________。 (3)明矾溶液与过量的Ba(OH)2溶液反应的离子方程式是______________________________。 (4)溶液A中通入过量CO2,反应的化学方程式是_____________________________________。 (5)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入__________和__________,溶液立即变红,证明固体B中含有铁。 |
|
| 20. 实验题 | 详细信息 |
有一含 Na2CO3·xH2O和 NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 CO2 和 H2O的质量,来确定 Na2CO3··xH2O中 x的数值。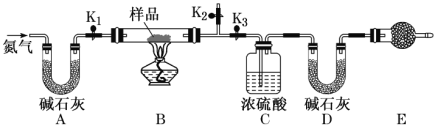 (1)实验步骤: ①按图(夹持仪器未画出)组装好实验装置后,检查装置的气密性。 ②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶 C 的质量和盛装碱石灰的 U形管 的质量。 ③打开活塞K1、K2,关闭K3,缓缓鼓入氮气数分钟,其目的是_________________________。 ④关闭活塞K1、K2,打开 K3,点燃酒精灯,加热至不再产生气体。加热时 NaHCO3 发生反应的化学方程式为___________________________________。 ⑤打开活塞 K1,缓缓鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和 U形管 D的质量。 (2)关于该实验方案,请回答下列问题。 ①装置 E的名称是_________,E中盛放的试剂也是碱石灰,其作用是_______________________________。 ②若样品质量为 29.3 g,反应后 C、D 装置增加的质量分别为 9 g、4.4 g,则 Na2CO3·xH2O中x为___________。 |
|
| 21. 解答题 | 详细信息 |
将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题: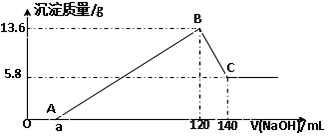 (1)写出BC段反应的离子方程式为____________________________。 (2)原Mg-Al合金的质量是_____________。 (3)原HCl溶液的物质的量浓度是________________。 (4)所加NaOH溶液的物质的量浓度是____________。 (5)a=______。 |
|
最近更新



