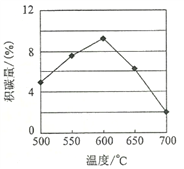
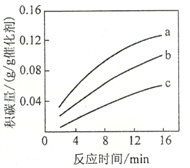
高一下册期末考试化学题同步训练免费试卷(2019-2020年安徽省淮南市第一中学)
| 1. 选择题 | 详细信息 |
|
美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,这很可能是 21 世纪人类最伟大的发现之一。其原理是无线电频率可以降低盐水中物质内部的“结合力”,从而释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”的实质是( ) A.离子键 B.分子间作用力 C.非极性共价键 D.极性共价键 |
|
| 2. 选择题 | 详细信息 |
|
科学家预测,月球的土壤中吸附着数百万吨 A. B. C.其原子核中质子数为 2、中子数为 1 D.核聚变是化学反应 |
|
| 3. 选择题 | 详细信息 |
|
在一定温度下,在体积不变的容器中发生可逆反应 2A(g)+B(s) A.C 的生成速率和B的消耗速率相等 B.容器内的压强不再发生变化 C.反应混合物中 A 的体积分数不再发生变化 D.2v 正(A)=v 逆(B) |
|
| 4. 选择题 | 详细信息 |
如图所示是部分短周期主族元素原子半径与原子序数的关系,则下列说法正确的是()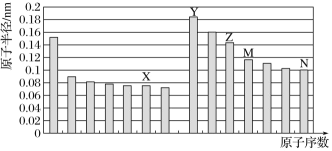 A.Z、N 两种元素形成的化合物属于盐,熔融状态下可以导电 B.X、N 两种元素的气态氢化物的沸点相比,前者较低 C.Z 的氧化物能分别溶解于 Y 的氢氧化物和 N 的氢化物的水溶液中 D.由 X 与 M 两种元素组成的化合物能与水反应 |
|
| 5. 选择题 | 详细信息 |
|
下列叙述中,不能用勒夏特列原理解释的是( ) A.红棕色的NO2,加压后颜色先变深后变浅 B.高压比常压有利于合成SO3 C.工业制取金属钾Na(l)+KCl(l) ⇌NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 D.加入催化剂有利于氨的合成 |
|
| 6. 选择题 | 详细信息 |
在好氧菌和厌氧菌作用下,废液中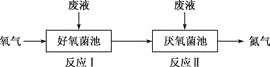 反应Ⅰ 反应Ⅱ 下列说法正确的是( ) A.两池发生的反应中,氮元素只被氧化 B.两池中投放的废液体积相等时, C.常温常压下,反应Ⅱ中生成 D. |
|
| 7. 选择题 | 详细信息 |
向 Na2CO3 溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( ). 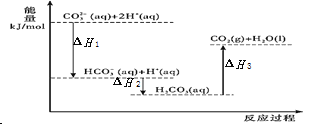 A.△H1 >△H2 ; △H2<△H3 B.反应 C. D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3 变小 |
|
| 8. 选择题 | 详细信息 |
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中, 发生反应 NH2COONH4(s) 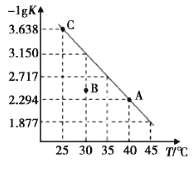 A.C 点对应状态的平衡常数 K(C)=10-3.638 B.该反应的ΔH>0 C.混合气体的平均相对分子质量不变时,该反应一定达到平衡状态 D.30℃时,B 点对应状态的 |
|
| 9. 选择题 | 详细信息 |
|
下列反应中ΔH>0,ΔS>0的是 A.HCl(g) + NH3(g)=NH4Cl(s) B.高温下能自发进行的反应:2N2O5(g)=4NO2(g) + O2(g) C.2H2(g) + O2(g)=2H2O(l) D.任何温度下均能自发进行的反应:COCl2(g)=CO(g) + Cl2(g) |
|
| 10. 选择题 | 详细信息 |
|
常压下羰基化法精炼镍的原理为:Ni(s) + 4CO(g) A.增加Ni的用量,可加快该反应速率 B.该反应达到平衡时,4v生成[Ni(CO)4]=v生成(CO) C.减压,平衡逆向移动,反应的平衡常数减小 D.选择合适的催化剂可提高CO转化率 |
|
| 11. 选择题 | 详细信息 |
298K 时,将 10 mL a mol·L-1 Na3AsO3、10 mL a mol·L-1 I2 和 10 mL NaOH 溶液混合,发生反应: A.溶液的 pH 不再变化 B.v正 (I-)=2 C. D.c( |
|
| 12. 选择题 | 详细信息 |
某温度下,在容积为2 L的密闭容器中投入一定量的A、B发生反应3A(g)+bB(g)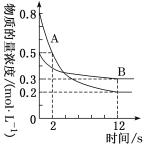 A.前12 s内,A的平均反应速率为0.025 mol·L-1·s-1 B.12 s后,A的消耗速率等于B的生成速率 C.化学计量数之比b∶c=1∶2 D.12 s内,A和B反应放出的热量为0.2Q kJ |
|
| 13. 选择题 | 详细信息 | ||||||||||
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)
|
|||||||||||
| 14. 选择题 | 详细信息 |
|
已知298K时,合成氨反应N2(g)+3H2(g) A.一定大于92.2kJ B.一定等于92.2kJ C.一定小于92.2kJ D.无法确定 |
|
| 15. 选择题 | 详细信息 | |||||||||||||||||||||||||
为探究NaHCO3、Na2CO3与1 mol·L-1盐酸反应(设两反应分别为反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据。下列有关说法正确的是( )
|
||||||||||||||||||||||||||
| 16. 选择题 | 详细信息 |
在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)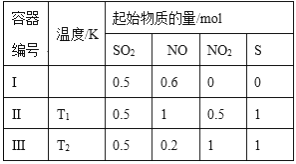 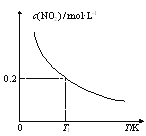 A.该反应的ΔH>0 B.T1时,该反应的平衡常数为 C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比大于1:2 D.若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数大于40% |
|
| 17. 选择题 | 详细信息 |
乙醇是重要的有机化工原料,可由乙烯水化法生产,反应的化学方程式如下: C2H4(g)+H2O(g)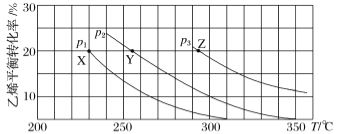 A.Y 对应的乙醇的物质的量分数为 B.X、Y、Z 对应的反应速率:v(X)>v(Y)>v(Z) C.X、Y、Z 对应的平衡常数数值:KX<KY<KZ D.增大压强、升高温度均可提高乙烯的平衡转化率 |
|
| 18. 选择题 | 详细信息 |
|
短周期元素 W、X、Y、Z、M,其原子序数依次增大,其中 W、X 同主族。Y 原子最外层电子数是 W 和 X 的最外层电子数之和的 3 倍,也是 Z 原子最外层电子数的 2 倍,M 的最高正价与最低价代数和为 6。下列说法正确的是( ) A.W—与 X+具有相同的电子结构,且离子半径 W—<X+ B.化合物 XZW4 的电子式 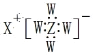 ,且该化合物具有较强的还原性 ,且该化合物具有较强的还原性C.与 Y 同主族的短周期元素 N 具有较强的非金属性,其含氧酸为强酸 D.M为短周期非金属性最强的非金属,在黑暗中即可与 W 单质剧烈反应 |
|
| 19. | 详细信息 | ||||||||||||||||||||||||||||||||||||
下面是元素周期表的一部分,参照元素①~⑧在表中的位置。
|
|||||||||||||||||||||||||||||||||||||
| 20. 综合题 | 详细信息 | |||||||||||||||
|
CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题: (1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。 已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1 C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1 C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1 该催化重整反应的ΔH==______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____(填标号)。 A.高温低压 B.低温高压 C.高温高压 D.低温低压 某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。 (2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。 相关数据如下表:
|
||||||||||||||||
| 21. | 详细信息 |
稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下: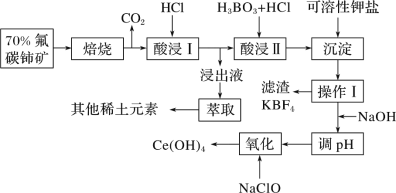 已知:①焙烧后烧渣中含+4 价的铈及+3 价的其他稀土氟氧化物; ②Ce4+能与 S 请回答下列问题: (1)CeFCO3 中,Ce 元素的化合价为________________________。 (2)“酸浸Ⅰ”过程中 CeO2 转化为 Ce3+,且产生黄绿色气体,用稀硫酸和 H2O2,替换 HCl 就不会造成环境污染。则稀硫酸、H2O2 与 CeO2 反应的离子方程式为_____________。 (3)“沉淀”步骤中发生的反应为 Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3 (aq)。则该反应的平衡常数表达式为:____________________ (用实际参加反应的离子表示)。 (4)浸出液”中含有少量 Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时 Ce4+与萃取剂[(HA)2]存在的反应为Ce4++n(HA)2 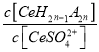 ,其他条件不变,在浸出液中加入不同量的 Na2SO4 以改变水层中的 c(S ,其他条件不变,在浸出液中加入不同量的 Na2SO4 以改变水层中的 c(S(5)CeO2 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧, 在尾气消除过程中发生着 CeO2 |
|
| 22. 填空题 | 详细信息 |
|
随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。利用 NH3的还原性可以消除氮氧化物的污染, 其中除去 NO 的主要反应如下:4NH3(g)+6NO(g) (1)一定温度下,在恒容密闭容器中按照 n(NH3)︰n(NO) =2︰3 充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是________________________。 A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H 键断裂的同时,生成 1molO—H 键 (2)已知该反应速率 (3)某研究小组将 2molNH3、3molNO 和一定量的O2充入 2L 密闭容器中,在 Ag2O 催化剂表面发生上述反应,NO 的转化率随温度变化的情况如图所示。 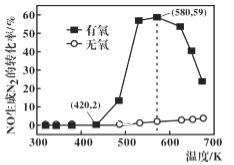 ①在 5min 内,温度从 420K 升高到 580K,此时段内NO 的平均反应速率 ②在有氧条件下,温度 580K 之后 NO 生成 N2的转化率降低的原因可能是_____________________。 |
|
| 23. | 详细信息 |
用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO 和 NO2 不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。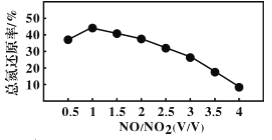 (1)用尿素[(NH2)2CO]水溶液吸收体积比为 1∶1 的 NO 和 NO2 混合气,可将 N 元素转变为对环境无害的气体。写出该反应的化学方程式___________________。 (2)随着 NO 和 NO2 配比的提高,总氮还原率降低的主要原因是__________________。 |
|