兰州市高一化学上册期中考试考题同步训练
| 1. 选择题 | 详细信息 |
|
胶体区别于其他分散系的本质特征是 A. 胶体的分散系能通过滤纸空隙,而浊液的分散质不能 B. 分散质粒子直径在1nm–100nm之间 C. 产生丁达尔效应 D. 胶体在一定条件下能稳定存在 |
|
| 2. 选择题 | 详细信息 |
|
离子方程式H++OH-=H2O可表示的化学反应是( ) A. 盐酸和氢氧化钡的反应 B. 硝酸和氢氧化镁的反应 C. 硫酸和氢氧化钡的反应 D. 盐酸和氢氧化铜反应 |
|
| 3. 选择题 | 详细信息 |
|
氧化还原反应的实质是( ) A.氧元素的得与失 B.化合价的升降 C.电子的转移 D.分子中原子重新组合 |
|
| 4. 选择题 | 详细信息 |
|
等质量的下列物质中,所含分子数最少的是( A. Cl2 B. HCl C. NH3 D. H2SO4 |
|
| 5. 选择题 | 详细信息 |
|
下列反应既属于化合反应,又属于氧化还原反应的是( ) A. Fe +2 HCl = H2 ↑+ FeCl2 B. 2FeCl2 + Cl2 = 2FeCl3 C. CaO + H2O = Ca(OH)2 D. 2Fe(OH)3 = Fe2O3 + 3H2O |
|
| 6. 选择题 | 详细信息 |
|
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是 A.氢氧化钠与盐酸,;氢氧化钠与碳酸 B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 D.石灰石与硝酸反应;石灰石与盐酸 |
|
| 7. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数,下列说法中正确的是( ) A. 1NA个氢气分子所占的体积为22.4 L B. 2NA个二氧化碳分子的质量为44g C. 1000 mL 0.1mol/L 的NaCl溶液中,Na+ 与Cl- 离子总数为0.2NA D. 17g氨气中所含原子数为NA |
|
| 8. 选择题 | 详细信息 |
|
实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。实验员选择了一种试剂就把它们区别开来了,这种试剂是 A.氢氧化钠溶液 B.盐酸 C.氯化钡溶液 D.硝酸 |
|
| 9. 选择题 | 详细信息 |
|
下列变化需要加入氧化剂才能实现的是( ) A. HCl → H2 B. NaCl → Cl2 C. CuSO4 → Cu D. HClO → Cl2 |
|
| 10. 选择题 | 详细信息 |
|
与22gCO2所含分子数相等的水的质量为( ) A.44g B.22g C.18g D.9g |
|
| 11. 选择题 | 详细信息 |
|
下列溶液中c(Cl-)与50 mL 1 mol·L-1 AlCl3溶液中c(Cl-)相等的是 ( ) A. 150 mL 1 mol·L-1的NaCl溶液 B. 75 mL 3 mol·L-1 MgCl2溶液 C. 150 mL 2 mol·L-1的KCl溶液 D. 75 mL 1 mol·L-1的FeCl3溶液 |
|
| 12. 选择题 | 详细信息 |
|
配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( ) A.容量瓶事先未烘干 B.定容时观察液面俯视 C.定容时观察液面仰视 D.定容后,摇匀时有少量液体流出 |
|
| 13. 选择题 | 详细信息 |
|
某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是 A.③②⑤①④ B.①②③⑤④ C.②③①⑤④ D.③⑤②①④ |
|
| 14. 选择题 | 详细信息 |
|
下列反应既是离子反应,又是氧化还原反应的是( ) A. 氯化钠溶液中滴入硝酸银溶液 B. 金属钠在氯气中燃烧 C. 铁片置于硫酸铜溶液中 D. 氢氧化钠溶液与稀硫酸反应 |
|
| 15. 选择题 | 详细信息 |
|
下列说法中正确的是 A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 B.NH3、SO2的水溶液均导电,所以NH3、SO2均是电解质 C.铜、石墨均导电,所以它们是电解质 D.蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质 |
|
| 16. 选择题 | 详细信息 |
|
下列叙述正确的是 A.1mol H2O的质量为18g/mol B.CH4的摩尔质量为16g C.3.01×1023个Cl2分子的质量为35.5g D.标准状况下,1mol任何物质的体积均约为22.4L |
|
| 17. 选择题 | 详细信息 |
|
将30 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为( ) A.0.3 mol/L B.0.03 mol/L C.0.05 mol/L D.0.04 mol/L |
|
| 18. 选择题 | 详细信息 |
|
下列各组中的离子,能在溶液中大量共存的是( ) A. K+、H+、SO42-、OH- B. Na+、Cu2+、Cl-、SO42- C. Na+、H+、Cl-、CO32- D. Na+、Ca2+、CO32-、NO3- |
|
| 19. 选择题 | 详细信息 |
|
下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓表示的是( ) A.Ba(NO3)2 +H2SO4=BaSO4↓+2HNO3 B.BaCl2+Na2SO4=BaSO4↓+2NaCl C.BaCO3+H2SO4=BaSO4↓+H2O+CO2↑ D.BaCl2+H2SO4=BaSO4↓+2HCl |
|
| 20. 选择题 | 详细信息 |
|
同温同压下,同体积的甲乙两种气体的质量比是17:14。若乙气体是CO,则甲气体是 A. H2S B. HCl C. NH3 D. Cl2 |
|
| 21. 选择题 | 详细信息 |
|
下列各组物质,按化合物、单质、混合物的顺序排列的是( ) A. 烧碱、液态氧、碘酒 B. 生石灰、白磷、熟石灰 C. 干冰、铁、氯化氢 D. 空气、氮气、胆矾 |
|
| 22. 选择题 | 详细信息 |
|
下列四种物质的溶液,其中一种能与其他三种发生离子反应,这种物质是 A.BaCl2 B.KOH C.H2SO4 D.Na2CO3 |
|
| 23. 选择题 | 详细信息 |
|
下列离子方程式中,正确的是( ) A.稀硫酸滴铜片上:Cu + 2H+ = Cu2+ + H2↑ B.氧化镁与稀盐酸:MgO + 2H+ = Mg2++ H2O C.铜片与硝酸银溶液:Cu + Ag+ = Cu2+ + Ag D.铁与稀硫酸 2 Fe + 6H+ = 2Fe3+ + 3H2↑ |
|
| 24. 选择题 | 详细信息 |
|
下列说法错误的是 A.从1L 1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L B.制成0.5L 10mol/L的盐酸,需要氯化氢气体112L(标准状况) C.0.5L 2mol/L的氯化钡溶液中,含有的氯离子数为2×6.02×1023 D.10g 98%硫酸(密度为1.84g/cm3)与10mL 18.4mol/L硫酸的浓度是不同的 |
|
| 25. 填空题 | 详细信息 |
|
在Fe3O4+4CO |
|
| 26. 填空题 | 详细信息 |
|
按要求写出方程式。 (1)碳酸钙和盐酸(写出离子方程式)______________________。 (2)氢氧化钡溶液和稀硫酸(写出离子方程式)______________________。 (3)Fe2(SO4)3(写出电离方程式)______________________。 (4)H+ + OH— = H2O(写出对应的化学方程式)______________________。 (5)CO32—+ 2H+ = CO2↑+ H2O(写出对应的化学方程式)______________________。 |
|
| 27. 填空题 | 详细信息 | ||||
鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的 Fe3+。这个变色的过程中的Fe2+被 (填“氧化”或“还原”)。若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有: (选择填空)。
|
|||||
| 28. 填空题 | 详细信息 |
|
用于分离或提纯物质的方法有: A蒸馏(分馏) B萃取 C过滤 D重结晶 E分液。 下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号) (1)除去Ca(OH)2溶液中悬浮的CaCO3微粒 。 (2)分离四氯化碳与水的混合物 。 (3)分离汽油和煤油 。 (4)分离碘水中的碘单质 。 (5)提纯氯化钠和硝酸钾混合物中的硝酸钾 。 |
|
| 29. 实验题 | 详细信息 |
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol·L-1的盐酸溶液。 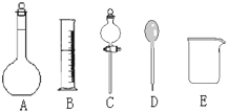 (1)在图所示仪器中,配制上述溶液不需要的是________(填序号);除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。 (2)根据计算,下列量程或规格中,本实验量筒应使用的是________; A.10mL B.100mL C.250mL D.500mL (3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)________。 ①待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。 ②往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。 ③在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。 ④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。 (4)在容量瓶的使用方法中,下列操作正确的是________。 A.使用容量瓶前不用检查它是否漏水 B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗 C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线处,1~2cm用胶头滴管加蒸馏水至刻度线 D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀 (5)若定容后摇匀静置,发现凹液面低于刻度线,此时应该________。 A.直接转移到细口试剂瓶中 B.再用胶头滴管加水,重新定容 C.将此溶液倒掉,重新配制 D.直接贮存于容量瓶中 |
|
| 30. 计算题 | 详细信息 |
|
实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。 ⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算) ⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算) ⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。 ①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀 |
|
高中化学 试卷推荐
- 2018至2019年高二下学期期中考试化学题开卷有益(内蒙古自治区鄂尔多斯市第一中学)
- 广东省普宁市2020-2021年高一上学期期末质量测试化学题免费试卷
- 湖南省娄底市双峰县双峰一中2021届高三第一次月考化学题带参考答案
- 2018至2019年高二下册期中考试化学考试完整版(福建省三明市第一中学)
- 2018年至2019年高一上册第一次月考化学试卷带参考答案和解析(青海省西宁市第四高级中学)
- 2019-2020年高一上学期期中考试化学考试完整版(河北省唐山市第十一中学)
- 大理白族自治州宾川县第三完全中学2019年高二化学上期开学考试免费试卷
- 2019年9月高一阶段性考试化学在线测验完整版(浙江省台州市五校联考)
最近更新



