镇原县第二中学试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
“美丽中国”是十八大提出的重大课题,她突出了生态文明,重点是社会发展与自然环境之间的和谐,下列行为中不符合这一主题的是 A.推广“低碳经济”,减少温室气体的排放 B.开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 C.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 D.关停化工企业,消除污染源头 |
|
| 2. 选择题 | 详细信息 |
|
下列各反应的化学方程式中,属于水解反应的是( ) A.H2O+H2O⇌H3O++OH- B. C.CO2+H2O⇌H2CO3 D. |
|
| 3. 选择题 | 详细信息 |
关于反应3O2(g) A.ΔH<0 ΔS<0 B.ΔH>0 ΔS<0 C.ΔH<0 ΔS>0 D.ΔH>0 ΔS>0 |
|
| 4. 选择题 | 详细信息 |
|
下列各组物质的燃烧热相等的是 A. C和CO B. 红磷和白磷 C. 3molC2H2(乙炔)和1molC6H6(苯) D. 1gH2和2gH2 |
|
| 5. 选择题 | 详细信息 |
|
以下是反A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率,反应速率最大的是 A.v(A)="0.15" mol•L-1•s-1 B.v(B)="0.6" mol•L-1•s-1 C.v(C)="0.4" mol•L-1•s-1 D.v(D)="0.45" mol•L-1•s-1 |
|
| 6. 选择题 | 详细信息 |
|
在由水电离出的c(H+)=10-13 mol·L-1的溶液中,一定能大量共存的离子组是() A.K+、Na+、 C.Na+、Cl-、 |
|
| 7. 选择题 | 详细信息 |
|
可逆反应2A(g)+B(g) A.  B. B.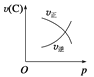 C. C.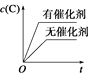 D. D.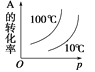 |
|
| 8. 选择题 | 详细信息 |
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述不正确的是( )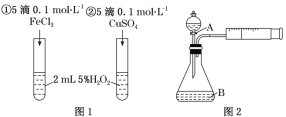 A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 B.用图2装置比较反应速率可通过测定在相同状况下反应产生一定体积气体所需时间的多少 C.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |
|
| 9. 选择题 | 详细信息 |
|
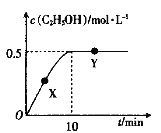
—定温度下,0.1molN2(g)与0.3molH2(g)在密闭容器中发生反应:N2(g)+3H2(g) A. 达到化学平衡状态时,反应放出0.la kJ热量 B. 达到化学平衡状态时,v正(NH3):v逆(N2)=2:1 C. n( N2):n(H2):n(NH3)=l:3:2时,说明该反应达到平衡 D. 缩小容器体积,用氮气表示的反应速率:v正(N2)增大,v逆(N2)减小 |
|
| 10. 选择题 | 详细信息 |
|
下列操作中,能使水的电离平衡向右移动,而且所得溶液显酸性的是 A.在水中加入少量氯化钠,并加热到100 ℃ B.在水中滴入稀硫酸 C.在水中加入小苏打 D.在水中加入氯化铝固体 |
|
| 11. 选择题 | 详细信息 |
|
在50mL 0.01mol/L H2SO4溶液加入 50mL 0.01mol/LNaOH溶液时,所得溶液呈( ) A.无法判断 B.碱性 C.中性 D.酸性 |
|
| 12. 选择题 | 详细信息 |
|
在密闭容器中发生反应:aA(g) A.A的转化率变大 B.平衡向逆反应方向移动 C.D的体积分数变大 D.a>c+d |
|
| 13. 选择题 | 详细信息 |
对于2SO2(g)+O2(g) ⇌2SO3(g),ΔH<0,根据下图,下列说法错误的是( )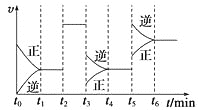 A.t2时使用了催化剂 B.t3时采取减小反应体系压强的措施 C.t5时采取升温的措施 D.反应在t6时刻,SO3体积分数最大 |
|
| 14. 选择题 | 详细信息 |
|
加热N2O5,依次发生的分解反应为:①N2O5(g) A. 4.25 B. 8.5 C. 17 D. 22.5 |
|
| 15. 选择题 | 详细信息 | ||||||||||||
已知某化学反应的平衡常数表达式K=
下列有关叙述不正确的是( ) |
|||||||||||||
| 16. 填空题 | 详细信息 |
| ①HClO4;②NaOH;③NH3•H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦CO2;⑧NaHSO4,_______是强电解质;_______是弱电解质;离子方程式中必须写成离子形式的是_______(以上直接填写编号) | |
| 17. 填空题 | 详细信息 |
|
常温下,pH相等的盐酸与醋酸溶液。 ①溶液中c(H+):盐酸_______醋酸(填大于、小于、等于、无法判断,下同); ②加入大小、形状、质量相同的锌粒,初始反应速率:盐酸_______醋酸; ③与足量的锌产生气体的体积(同压):盐酸_______醋酸; ④加水稀释相同的倍数后pH的变化:盐酸_______醋酸; ⑤当酸的pH=3,与pH=11的NaOH溶液等体积混合,混合后pH变化:盐酸_______醋酸。 |
|
| 18. | 详细信息 | ||||||||||
|
习总书记在十九大报告中明确指出:“宁要绿水青山,不要金山银山,而且绿水青山就是金山银山。”保护环境是我们的迫切需要。请回答下列问题: (1)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g) 已知几种化学键的键能数据如表:
根据键能数据估算上述反应中ΔH=_______kJ/mol。 |
|||||||||||
| 19. 填空题 | 详细信息 |
|
已知常温下,0.1mol/L的某一元酸HA的水溶液中,有0.1%的HA发生电离。请回答下列问题: (1)该溶液的pH=_______。 (2)HA的电离平衡常数Ka=_______。 (3)要使溶液中 A.加少量烧碱固体 B.通少量HCl气体 C.加水 D.升高温度 E.加少量NaA固体 (4)常温下,0.1mol/L的NaA溶液显_______性(填“酸”、“中”或“碱”),原因是(用离子方程式表示)_______。 (5)常温下,已知NH4A溶液呈中性,HA溶液滴加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH_______7(填“>”、“<”或“=”)。 |
|
| 20. 实验题 | 详细信息 | ||||||||||||||||||
|
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上; ②固定好滴定管并使滴定管尖嘴处充满液体; ③调节液面至“0”或“0”刻度线以下,并记下读数; ④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液; ⑤用标准液滴定至终点,记下滴定管液面读数。 请回答下列问题: (1)以上步骤有错误的是_______(填编号)。若测定结果偏高,其原因可能是_______(多选填字母)。 A.滴定过程中振荡时有液滴溅出 B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗 D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 (2)判断滴定终点的现象是_______。 (3)如图是某次滴定时滴定管中的液面,其读数为_______mL。 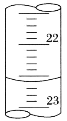 (4)根据表中数据,请计算待测盐酸的浓度:_______mol·L-1(保留四位有效数字)。
|
|||||||||||||||||||
| 21. 计算题 | 详细信息 |
|
在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L。 (1)求该反应的平衡常数______。 (2)在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度______。 |
|