安徽2020年九年级化学前半期中考模拟试卷带解析及答案
| 1. | 详细信息 |
|
春天是万物复苏的季节,下列过程涉及化学变化的是 A.春天酿桑葚酒 B.春雨洗刷嫩叶 C.春水滚滚东流 D.春风吹拂柳枝 |
|
| 2. | 详细信息 |
|
2020年是全面建成小康社会和“十三五”规划的收官之年,也是打赢污染防治攻坚战的决胜之年。下列措施符合保护环境的理念是 A.森林公园里的残枝落叶可就地掩埋 B.工业污水只要是无色无味的就可以直接排入湖泊 C.垃圾无需分类,全部直接焚烧 D.施用农药是重要的农作物保护手段,可大量使用 |
|
| 3. | 详细信息 |
锌元素对人体健康有着重要作用,图甲是锌元素在元素周期表中的相关信息,图乙是锌原子结构示意图,下列说法正确的是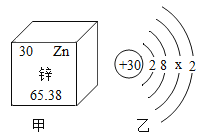 A.锌是人体必需的常量元素 B.图乙中x=8 C.锌的相对原子质量为65. 38 g D.锌原子在化学变化中容易失去电子,形成阳离子 |
|
| 4. | 详细信息 |
|
下列实验操作能达到实验目的是 A.  收集氧气 B. 收集氧气 B. 测定盐酸pH 测定盐酸pHC.  稀释浓硫酸 D. 稀释浓硫酸 D.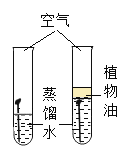 探究铁生锈的条件 探究铁生锈的条件 |
|
| 5. | 详细信息 |
|
研究表明喷洒过氧乙酸(C2H4O3)消毒液可有效灭活病毒,此消毒液属高效消毒剂,其高浓度属于易爆品。过氧乙酸消毒液一般市售浓度在20%,生活中需要稀释后才能使用。下列说法正确的是 A.过氧乙酸消毒液属于有机化合物 B.过氧乙酸完全燃烧生成二氧化碳和水 C.每个过氧乙酸由9个原子构成 D.过氧乙酸中氢元素质量分数最大 |
|
| 6. | 详细信息 |
由宏观到微观的认识过程是化学学科对提升核心素养作出的独特贡献。清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下图(图中的微粒恰好完全反应)。下列说法不正确的是 A.反应中甲.乙两种物质的质量比为3 : 22 B.丁的化学式为H2O,该反应为复分解反应 C.反应一段时间,只需要增加反应物,不需要更换催化剂、 D.该反应的研究,有助于降低二氧化碳的排放 |
|
| 7. | 详细信息 |
|
学习化学要构建基本观念,对以下基木观念的认识正确的是 A.绿色观: H2是最理想的清洁、高能燃料 B.结构观:元素原子最外层电子数相同,化学性质一定相似 C.宏微观:高压电线夏天变长,是因为温度越高,分子运动越剧烈 D.守恒观:铁丝放入硫酸铜溶液中,一段时间后金属丝质量增大,不符合质量守恒定律 |
|
| 8. | 详细信息 | ||||||||
实验室制备并收集二氧化碳,按下表进行实验。取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳体积随时间变化曲线如图所示。下列说法错误的是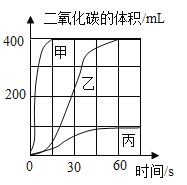
|
|||||||||
| 9. | 详细信息 | ||||||||
归纳总结是学习化学的重要方法。下表各组对主题知识的归纳中全部错误的是
|
|||||||||
| 10. | 详细信息 |
如图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。下列说法正确的是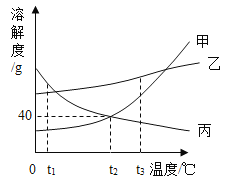 A.三种物质溶解度的大小关系是甲>乙>丙 B.t3°C时,将三种物质的饱和溶液恒温蒸发等质量的水,析出晶体的质量关系是乙>甲>丙 C.t2°C时,甲和丙的饱和溶液中溶质的质量分数均为40% D.t2°C时,丙的不饱和溶液可通过降温变成饱和溶液 |
|
| 11. | 详细信息 |
|
化学与人类密切相关,我们身边到处都是化学物质。 (1)饮用硬度过大的水不利于人体健康,生活中常用___________来鉴别硬水软水。 (2)生活中,通常选择铜丝作为导线,是利用其____________性。 (3)实验室比较锌和银的金属活动性强弱,用化学方程式表示:_____________________________。 (4)化学为人类发展作出了巨大贡献,但也带来了污染,请你写出一种生活中防止污染的做法:_____。 |
|
| 12. | 详细信息 |
如图是实验室制取气体的一些装置,请你回答有关问题。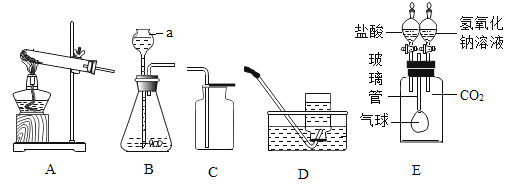 (1)写出仪器a的名称:________________。 (2)实验室用加热高锰酸钾的方法制取并收集较纯净的氧气,应选用____________(填序号)装置组合。其反应的化学方程式为____________。 (3)利用装置E(集气瓶中预先装满CO2气体)来验证CO2的性质,先加入足量氢氧化钠溶液,观察到的现象是气球__________(填“变大”“变小”或“不变”),化学反应方程式为___________;再加入足量盐酸,观察到的现象是气球___________(填“变大”“变小”或“不变”)。 |
|
| 13. | 详细信息 |
在新冠肺炎防疫中,84消毒液是常用的消毒剂,其消毒的有效成分是次氯酸钠(化学式是NaClO)。次氯酸钠工业生产原料来源是粗盐,粗盐中含有硫酸钠、氯化镁、氯化钙和泥沙等杂质,流程如下: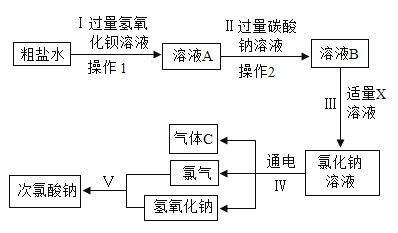 (1)标出次氯酸钠中氯元素的化合价:________________。 (2)操作1中会用到玻璃棒,其作用是________________;在流程Ⅲ中,加入的溶液是_________。 (3)写出流程Ⅲ中发生的其中任一个化学反应方程式:________________,其反应类型是________。 (4)操作2中加入的过量碳酸钠溶液,不仅除去了粗盐中含有的氯化钙杂质,还除去了_________。 |
|
| 14. | 详细信息 |
|
我校化学兴趣小组同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究。 (知识回放)通过判断上述四种溶液两两之间能否发生反应,我能写出其中一个中和反应的化学方程式:________________。 (挖掘实质) (1)图1是HCl和NaOH在水中解离出离子的示意图,我发现HCl和NaOH在水中会解离出相应离子,以此类推硝酸钡在水中会解离出Ba2+和_______________(填离子符号)。 (2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为___,我也能用同样的方式表示上述四种溶液两两之间发生反应时且有气体生成的反应的实质是 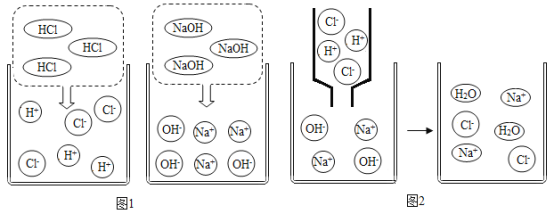 (3)通过探究上述四种溶液两两之间是否发生反应的实质,我发现NaOH和H2SO4溶液能发生复分解反应.因为溶液中的H+和OH-不能大量共存;H2SO4溶液和Ba(NO3)2溶液也可以发生复分解反应,因为Ba2+和SO42-在溶液中____________(填“能”或“不能”)大量共存;NaOH和K2CO3溶液不能发生复分解反应,因为_____和Na+和OH-能大量共存。 (知识升华)通过对“复分解反应发生的条件”的再探究,我得出复分解反应发生条件的实质是离子交换,只要反应物中某些离子浓度减小了(或不能大量共存),复分解反应就可以发生。 |
|
| 15. | 详细信息 | ||||||||
|
我国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(FeSO4﹒7H2O)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。 (1)写出铁与稀硫酸反应的化学方程式:________________。 (2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(FeSO4﹒7H2O)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动: (查阅资料) ①FeSO4易被空气中的氧气氧化成Fe2 (SO4)3而变质。 ②Fe2+能使紫色酸性高锰酸钾溶液褪色。 ③Fe3+的检验:向含Fe3+的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。 (猜想与假设)猜想1:该硫酸亚铁溶液没有变质; 猜想2:该硫酸亚铁溶液部分变质; 猜想3:________________。 (设计实验并验证)
|
|||||||||
| 16. | 详细信息 |
| 将12. 5 g含碳酸钙80%的石灰石样品放入烧杯中(杂质既不溶于水,也不参加反应),加入稀盐酸至恰好完全反应,共用去稀盐酸100 g,请计算所用稀盐酸的溶质质量分数。 | |
最近更新



