盈江县第一农业中学九年级化学月考测验(2019年上半期)试卷带答案和解析
| 1. 选择题 | 详细信息 |
生活中一些物质的pH如图所示: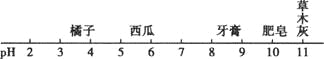 以下有关说法中错误的是( ) A. 西瓜汁显酸性 B. 胃酸过多的人不宜多吃橘子 C. 肥皂水可以使石蕊试剂变红 D. 草木灰可以改良酸性土壤 |
|
| 2. 选择题 | 详细信息 |
|
托盘天平调平后,托盘天平上各放一只质量相等的烧杯,在烧杯中分别加入质量分数相同的等质量的硫酸溶液,然后在左盘烧杯中加入2.5克铝粉,右盘烧杯中加入2.5克铁粉,充分反应后,两烧杯中都没有固体剩余物,则此时托盘天平() A. 左盘重 B. 右盘重 C. 仍然平衡 D. 无法判断 |
|
| 3. 选择题 | 详细信息 |
|
比较推理是化学学习中常用的思维方法,下列推理正确的是() A. 镁条可在空气中燃烧,故铁丝也可在空气中燃烧 B. 金刚石很硬,故石墨也很硬 C. 二氧化碳可以灭火,故一氧化碳也能灭火 D. 生铁比纯铁硬,故黄铜比纯铜硬 |
|
| 4. 选择题 | 详细信息 |
|
把 CaCO3、NaCl、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是( ) A.H2O NaOH HCl B.H2O KOH HCl C.H2O NaOH H2SO4 D.H2O KOH H2SO4 |
|
| 5. 选择题 | 详细信息 |
|
下列有关资源的说法错误的是( ) A. 回收利用废旧金属可以减少污染 B. 目前世界上年产量最多、使用最多的金属是铁 C. 地球上的金属资源只广泛存在于地壳中,多数以化合物的形式存在 D. 目前已经广泛用塑料来代替钢和其他金属制造管道、齿轮和汽车零部件等 |
|
| 6. 选择题 | 详细信息 |
|
合理开发和使用资源是人类可持续发展的前提,下列保护资源的措施中错误的是( ) A. 铁栏杆上刷一层油漆,以保护金属资源 B. 工业废水处理后循环使用,以保护水资源 C. 汽车安装尾气净化装置,以节约石油资源 D. 严禁使用一次性木筷,以保护森林资源 |
|
| 7. 选择题 | 详细信息 |
|
令人瞩目的中国第一艘航空母舰“辽宁号”在2012年9月25日正式交接入役,编入中国海军服役,航母在制造过程中用的材料要求很高,特别是飞行甲板用的钢要求极高,强度甚至高于核潜艇。下列关于上述材料的叙述正确的是( ) A. 它是一种非金属材料 B. 它是一种合金,其硬度比其该合金中金属成分单质的硬度更小 C. 它与其他金属材料一样都具有导热性 D. 它是由两种或两种以上的金属经一定方法合成的具有金属特性的物质 |
|
| 8. 选择题 | 详细信息 |
|
生铁与足量稀盐酸反应,往往会出现少量不溶物,该不溶物是( ) A. Fe B. C C. FeCl2 D. FeCl3 |
|
| 9. 选择题 | 详细信息 |
|
下列属于复合肥料的是 A. NaNO3 B. K2SO4 C. NH4H2PO4 D. Ca3(PO4)2 |
|
| 10. 选择题 | 详细信息 | |||||||||||||||||||||||||
如表提供的四组物质符合图示,相连物质间在一定条件下可以发生反应的是()
|
||||||||||||||||||||||||||
| 11. 选择题 | 详细信息 | ||||||||
钛(Ti)和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组在实验室探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度足量稀盐酸中,观察现象如下:
|
|||||||||
| 12. 选择题 | 详细信息 | ||||||||
整理与归纳是学习化学的重要方法。对某一主题的知识归纳,有错误的是()
|
|||||||||
| 13. 选择题 | 详细信息 |
|
下列金属单质能与稀硫酸发生置换反应的是 A. 铁 B. 金 C. 铜 D. 银 |
|
| 14. 选择题 | 详细信息 |
|
关于金属物品的使用正确的是( ) A. 铝合金门窗变旧变暗后可用砂纸或钢丝球打磨 B. 铝壶内的水垢可用溶质质量分数为18%的盐酸长时间浸泡 C. 校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈 D. 铁桶可以长时间保存波尔多液 |
|
| 15. 选择题 | 详细信息 |
|
天平两边各放同质量分数、同质量、足量的盐酸,在左边烧杯中放3.6g铝粉,为了使天平保持平衡,右边烧杯应放锌粉的质量是() A. 3.6g B. 3.92g C. 3.49g D. 3.3g |
|
| 16. 填空题 | 详细信息 |
|
按要求选择适当的物质,用其前面的字母填空。 A.肥皂水 B.干冰 C.洗洁精 D.食醋 (1)人工降雨可使用________。 (2)除去水壶中的水垢用________。 (3)区分硬水和软水用________。 (4)洗去碗筷上的油污用________。 |
|
| 17. 简答题 | 详细信息 |
如图是甲、乙两种固体物质的溶解度曲线,根据图回答问题: (1)t1℃时,甲、乙两种物质的溶解度甲________乙(填“>”“=”或“<”)。 (2)若想从甲的饱和溶液中获得甲晶体,常采用____________方法。 (3)t2℃时,将15g甲放入装有50g水的烧杯中,所得溶液溶质的质量分数为________。 (4)A点状态中乙溶液属于________溶液(填“饱和”或“不饱和”)。 |
|
| 18. 填空题 | 详细信息 |
| 溶液的饱和与不饱和,只有指明________,才有确定的意义。 | |
| 19. 填空题 | 详细信息 |
| 肥皂水的pH>7,肥皂水呈________性,能使无色酚酞溶液变________色;白醋的pH________,白醋呈酸性,能使紫色石蕊溶液变________色;溶液的pH越________,则溶液的酸性越强;溶液的pH越大,则溶液的碱性越________。 | |
| 20. 流程题 | 详细信息 |
|
某学校研究小组从废干电池筒内的物质(含有C、MnO2、ZnCl2、NH4Cl等)进行回收MnO2实验,过程如下: (1)操作①、②、③依次为下图中的____________。(填字母)  (2)操作②后要进行洗涤,判断洗净的方法是:取最后6次洗涤液,加入________溶液,如果不生成白色沉淀,则说明已洗净。操作③中发生反应的化学方程式为________________________。 (3)为检验获得的MnO2,可在试管中加入获得的MnO2和适量的过氧化氢溶液混合,反应化学方程式为__________________,在试管口用________检验生成的气体。 |
|
| 21. 填空题 | 详细信息 |
|
请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性: (1)硝酸钾(KNO3) _____,硫酸钾(K2SO4) _____,碳酸钾(K2CO3) _____。 (2)碳酸钙(CaCO3) _____,碳酸钡(BaCO3) _____,碳酸铜(CuCO3) _____。 (3)氯化铵(NH4Cl) _____,硝酸铵(NH4NO3) _____,碳酸铵〔(NH4)2CO3〕_____。 |
|
| 22. 实验探究题 | 详细信息 | ||||||||
|
小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度.于是他对所得溶液的酸碱性进行探究. (探究目的)探究所得溶液的酸碱性 (提出猜想)所得溶液可能呈碱性,也可能呈_____性,还可能呈_____性. (实验验证)
|
|||||||||
| 23. 实验探究题 | 详细信息 |
某课外活动小组同学用图中装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程如下: ①取一段镁带样品,准确称得其质量为0.030 g; ②往量气管内装水至低于刻度“0”的位置,如图所示,(未装药品)装配好仪器; ③_________________________; ④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞; ⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置; ⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应; ⑦待冷却至室温后,再次记录量气管中液面位置; ⑧算出量气管中增加的气体体积为23.96 mL; 已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。 请回答下列问题: (1)写出镁与稀硫酸反应的化学方程式:____________________。 (2)能否用托盘天平称量0.030 g镁带样品________(填“能”或“不能”)。 (3)操作③是_________________________。 (4)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果________(填“是”或“否”),理由是_______________________。 (5)若实际测得氢气的体积与理论值相比偏大,则可能的原因是________________________。 |
|
| 24. 简答题 | 详细信息 | ||||||||||||||
某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液.为防止直接排放造成环境污染,对其进行了处理,过滤该残液,取100g 滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得实验数据如下表:
|
|||||||||||||||




