2019届高三前半期第四次月考化学(西藏自治区林芝二高)
| 1. 选择题 | 详细信息 |
|
生活中下列处理方法正确的是 A. 蚂蚁叮咬的红肿处涂沫苯酚止痒 B. 冬天在汽车水箱中加乙二醇抗冻 C. 纺织品上的油腻用烧碱溶液清洗 D. 把铁器具浸入水隔绝空气防生锈 |
|
| 2. 选择题 | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列叙述正确的是 A. 9g超重水(3H216O)含中子数为6NA B. 标准状况下,22.4L CCl4含有的分子数目为NA C. 78g过氧化钠中含有的阴阳离子总数为4NA D. 28g乙烯与聚乙烯的混合物完全燃烧生成水的分子数为2NA |
|
| 3. 选择题 | 详细信息 |
某有机化合物的结构简式为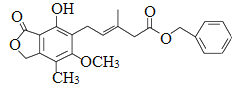 ,下列关于该化合物的说法不正确的是 ,下列关于该化合物的说法不正确的是A. 该有机物的分子式为C23H24O6 B. 1mol该化合物最多可以与9molH2发生加成反应 C. 既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色 D. 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 |
|
| 4. 选择题 | 详细信息 | ||||||||||||||||||||
对下列实验现象解释正确的是
|
|||||||||||||||||||||
| 5. 选择题 | 详细信息 |
已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是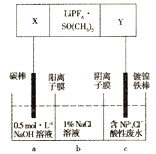 A. 电极Y为Li B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小 C. X极反应式为FeS+2Li++2e-=Fe+Li2S D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变 |
|
| 6. 选择题 | 详细信息 |
|
短周期元素a、b、c、d的原子序数依次增大,由以上四种元素组成的一种化合物m在加热时完全分解为三种产物,其中一种产物n 是能使湿润的红色石蕊试纸变蓝的气体,另一种产物q是无色无味的能使澄清石灰水变浑浊的气体。下列说法正确的是 A. 原了半径:a<b<c<d B. b、c、d 的简单氢化物的热稳定性依次增强 C. a、c、d 三种元素形成的化合物一定会抑制水的电离 D. m、n、q三种物质中只含共价键 |
|
| 7. 选择题 | 详细信息 |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是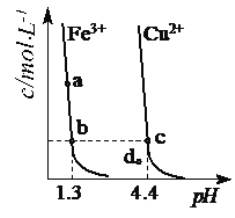 A. [Ksp[Cu(OH)2]<Ksp[Fe(OH)3] B. d点代表的溶液中Fe(OH)3已过饱和、Cu(OH)2未饱和 C. 加适量NH4Cl固体可使溶液由a点变到b点 D. b、c两点代表的Fe(OH)3、Cu(OH)2溶解度相等 |
|
| 8. 实验题 | 详细信息 |
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。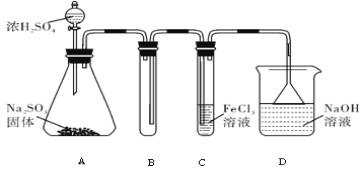 (1)配制氯化铁溶液时,需先把氯化铁晶体溶解在______中,再加水稀释,这样操作的目的是__________________________________________。 (2)通入足量SO2时,装置C中观察到的现象为___________________________________。 (3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。 ①写出SO2与FeCl3溶液反应的离子方程式____________________________________; ②请设计实验方案检验有Fe2+ 生成___________________________________________; ③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42 -,该做法____(填“合理”或“不合理”),理由是__________。 (4)D装置中倒置漏斗的作用是_________________________________________________。 (5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有____________(填字母)。 a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液 |
|
| 9. 综合题 | 详细信息 | ||||||||||||||
锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下: 已知 25 ℃时,部分物质的溶度积常数如下:
|
|||||||||||||||
| 10. 综合题 | 详细信息 | ||||||||||
|
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下: ①CO2(g)+3H2(g) ②CO2(g)+H2(g) ③CH3OH(g) 回答下列问题: (1)已知反应②中相关化学键键能数据如下:
|
|||||||||||
| 11. 填空题 | 详细信息 |
|
硫、钴及其相关化合物用途非常广泛。回答下列问题: (1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co) < I4(Fe),其原因是_______;Co 与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______. (2) 单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。 (3) K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。 (4)S 与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。 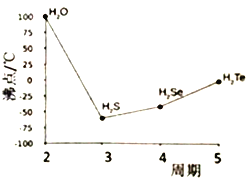 (5)钴的一种化合物晶胞结构如下图所示。 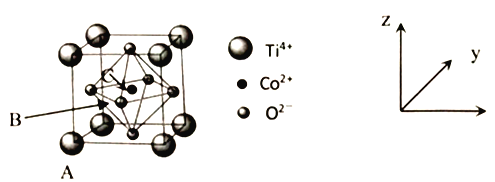 ①已知A点的原子坐标参数为为(0,0,0),B点为( ②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3 (列出计算表达式即可)。 |
|
| 12. 推断题 | 详细信息 |
聚合物H (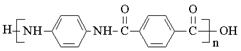 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: 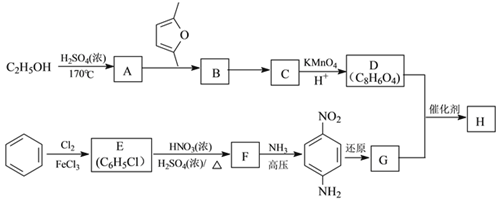 已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。 ②Diels-Alder反应: (1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。 (2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。 (3)D+G→H的化学方程式是______。 (4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。 (5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成  ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。 |
|