陕西高一化学期中考试(2020年下半期)试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
下列元素中,不属于主族元素的是 A.磷 B.铁 C.钙 D.砹 |
|
| 2. 选择题 | 详细信息 |
下列原子(离子)的结构示意图正确的是( )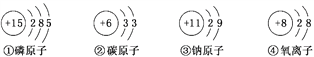 A. ①② B. ②③ C. ③④ D. ①④ |
|
| 3. 选择题 | 详细信息 |
|
科学家预测,月球的土壤中吸附着数百万吨He,100吨He核聚变释放的能量相当于目前人类一年消耗的能量。下列说法正确的是( ) A. He的最外层电子数为2,具有较强的金属性 B. He位于周期表第二周期第ⅡA族 C. 其原子核中质子数为2、中子数为1 D. 核聚变是化学反应 |
|
| 4. 选择题 | 详细信息 |
|
下列变化中不需要破坏化学键的是 A.加热氯化铵 B.Na2CO3熔化 C.干冰气化 D.氯化氢溶于水 |
|
| 5. 选择题 | 详细信息 |
|
下列反应中既属于氧化还原反应,又属于吸热反应的是 A.灼热的碳与CO2反应 B.Ba(OH)2·8H2O与NH4Cl反应 C.甲烷在氧气中燃烧 D.铝片与稀硫酸反应 |
|
| 6. 选择题 | 详细信息 |
|
利用化学反应:Fe+CuSO4==FeSO4+Cu,可以设计出一种原电池。该原电池工作时 A.Fe为正极 B.Cu为负极 C.正极上发生氧化反应 D.负极上发生氧化反应 |
|
| 7. 选择题 | 详细信息 |
|
下列关于物质性质变化的比较,正确的是 A.碱性强弱:KOH>NaOH>Mg(OH)2 B.原子半径大小:Cl> Na>O C.稳定性:HI>HBr>HCl>HF D.还原性强弱:Cl- > Br- > I- |
|
| 8. 选择题 | 详细信息 |
|
下列叙述错误的是 A.通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应 B.甲烷是正四面体结构 C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3,还是CCl4,都属于取代反应 D.甲烷的四种取代物常温下均为液体 |
|
| 9. 选择题 | 详细信息 |
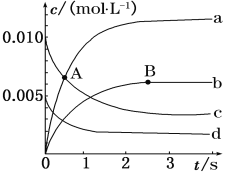
如图所示,有关化学反应和能量变化的说法正确的是( ) A. 图a表示的是吸热反应的能量变化 B. 图b中反应物比生成物稳定 C. 图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化 D. 图a不需要加热就能发生,图b一定需要加热才能发生 |
|
| 10. 选择题 | 详细信息 |
|
下列说法正确的是 A. Li是最活泼金属,F是最活泼非金属 B. Mg(OH)2碱性比Ca(OH)2强 C. 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 D. X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
|
| 11. 选择题 | 详细信息 |
|
下列说法正确的是 A.非金属原子间不可能形成离子键; B.不同原子形成的化学键一定是极性键; C.共价化合物中不可能含离子键; D.离子化合物中不可能含有共价键。 |
|
| 12. 选择题 | 详细信息 |
|
下列反应中,能够说明乙烯分子具有不饱和键的是( ) A.燃烧反应 B.取代反应 C.加成反应 D.化合反应 |
|
| 13. 选择题 | 详细信息 |
|
下列说法正确的是 A.化学键的断裂过程中放出热量 B.化学键形成的过程需要吸收热量 C.伴有能量变化的物质变化都是化学变化 D.化学反应除了生成新的物质外,还伴随着能量的变化 |
|
| 14. 选择题 | 详细信息 |
如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是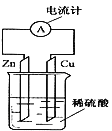 A.电流从铜片经导线流向锌片 B.该装置将电能转变为化学能 C.一段时间后,铜片质量减轻 D.锌片发生还原反应 |
|
| 15. 选择题 | 详细信息 |
|
下列性质中,可证明某化合物内一定存在离子键的是 A.可溶于水 B.熔融状态能导电 C.水溶液能导电 D.具有较高的熔点 |
|
| 16. 选择题 | 详细信息 |
|
实验室用100 mL 1 mol·L-1硫酸与锌粉反应制备氢气,下列措施一定能加快反应速率的是 A.改用300 mL 1 mol·L-1硫酸 B.降低温度 C.用锌粒代替锌粉 D.滴加少量CuSO4溶液 |
|
| 17. 选择题 | 详细信息 |
|
在一定温度下,可逆反应2A(g)+B(g) A.C的生成速率和B的消耗速率相等 B.v正(A)=2v正(B) C.反应混合物中A、B、C、D的物质的量分数不再发生变化 D.2v正(A)=v逆(B) |
|
| 18. 选择题 | 详细信息 |
|
有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是 A.NaH B.H2O C.HCl D.HClO |
|
| 19. 选择题 | 详细信息 |
|
下列叙述正确的是 A. 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 B. 除短周期外,其它周期均为18种元素 C. 碱金属元素是指ⅠA族的所有的元素 D. 副族元素没有非金属元素 |
|
| 20. 选择题 | 详细信息 |
|
已知N2+3H2 A.N2的能量一定高于NH3 B.H2的能量一定高于NH3 C.N2和H2的总能量一定高于NH3的总能量 D.因该反应为放热反应,故不必加热就可发生 |
|
| 21. 选择题 | 详细信息 |
|
在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称为 A.硒 B.硫 C.砷 D.锗 |
|
| 22. 选择题 | 详细信息 |
|
在一密闭容器中进行反应:2SO2+O2 A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1 B.SO2为0.3 mol·L-1 C.SO3为0.4 mol·L-1 D.SO2、SO3均为0.1 mol·L-1 |
|
| 23. 选择题 | 详细信息 |
下图是铁棒和碳棒在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断正确的是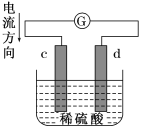 A.电池工作的过程中,c电极上产生气泡 B.电池工作时,溶液中H+和Fe2+向d移动 C.d为负极,发生氧化反应 D.电池工作的过程中,溶液中SO |
|
| 24. 选择题 | 详细信息 |
|
丁烷(C4H10)一氯代物C4H9Cl的同分异构体数目共有 A.2种 B.3种 C.4种 D.5种 |
|
| 25. 选择题 | 详细信息 | ||||||||||||||||||
|
根据表1信息,判断以下叙述正确的 表1 部分短周期元素的原子半径及主要化合价
|
|||||||||||||||||||
| 26. 选择题 | 详细信息 |
|
下列叙述中不正确的是 ①质子数相同的粒子一定属于同种元素 ;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同种元素的粒子;⑤一种元素只能有一种质量数;⑥某种元素的相对原子质量取整数,就是其质量数 A.①②④⑤ B.①②⑤⑥ C.②③⑤⑥ D.③④⑤⑥ |
|
| 27. 填空题 | 详细信息 |
2SO2(g)+O2(g) 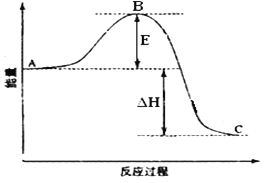 请回答下列问题: (1)此反应为:_____________(填“吸热反应”或“放热反应”)。 (2)图中E的大小对该反应的反应热________(填“有”或“无”)影响。该反应通常用V2O5作催化剂加快反应速率,加V2O5会使图中B点_________ (填“升高”还是“降低”)。 |
|
| 28. 填空题 | 详细信息 |
|
按要求填写下列空白: (1)写出表示含有8个质子、10个中子的原子的化学符号:__________。 (2)周期表中最活泼的非金属元素位于第__________纵行。 (3)周期表中位于第4周期、ⅡA族的元素符号是:___________ 。 (4)所含元素为18种的周期是第_________周期、第________周期。 (5)写出第2周期、ⅤA族元素单质的电子式:______________ 。 |
|
| 29. 填空题 | 详细信息 |
|
致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。 据现有知识,某些元素化合物的易燃性、毒性变化趋势如下: (1)氢化物的易燃性:第二周期 ______>______>H2O、HF。 (2)化合物的毒性: PH3>NH3 ; H2S______H2O; CCl4_____CF4 (选填>或<)。于是科学家们开始把注意力集中在含F、Cl的化合物上。 (3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了。求助于周期表中元素及其化合物的________变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分)①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色 A、①③⑤ B、①②③ C、 ②③④ D、③④⑤ |
|
| 30. 填空题 | 详细信息 | ||||||||||||||
在2 L密闭容器中,800 ℃时,反应2NO+O2
|
|||||||||||||||
| 31. 填空题 | 详细信息 |
|
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。 (1)E元素在周期表中的位置为_________________。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式________________________________。 (2)由A、B两种元素组成的18电子微粒的分子式为____________________。 (3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_________________________________________。 (4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。 |
|
最近更新