2017-2018年高一上册期末考试化学免费试卷完整版(黑龙江省哈尔滨市第九中学)
| 1. 选择题 | 详细信息 |
|
2016年10月17日,神州十一号飞船在酒泉卫星发射中心成功发射,根据太空的失重状况,下列化学实验在太空中无法完成的是 A. 过滤 B. 两种固体混合 C. 硫酸与氢氧化钠溶液的中和反应 D. 蒸发 |
|
| 2. 选择题 | 详细信息 |
|
氯气是一种化学性质很活泼的非金属单质,下列说法不正确的是 A. 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 B. 钠在氯气中燃烧,生成白色的烟 C. 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 D. 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
|
| 3. 选择题 | 详细信息 |
|
下列有关物质分类的说法中正确的是 A. Na2O2,Al2O3,Fe3O4 都是碱性氧化物 B. 醋酸、氯气、CO2都是电解质 C. 水玻璃、氯水、氢氧化铁胶体都是混合物 D. 纯碱、火碱、消石灰都是碱 |
|
| 4. 选择题 | 详细信息 |
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是 ( )  A. 蒸馏、蒸发、分液、过滤 B. 蒸馏、过滤、分液、蒸发 C. 分液、过滤、蒸馏、蒸发 D. 过滤、蒸发、分液、蒸馏 |
|
| 5. 选择题 | 详细信息 |
|
下列除去杂质的方法正确的是 A. 除去KI溶液中的碘单质: 加入乙醇萃取后分液 B. 除去KC1溶液中的少量MgCl2: 加入适量NaOH溶液,过滤 C. 除去CO2气体中混有的CO气体: 混合气通过灼热的铜网 D. 除去BaSO4中少量BaCO3: 加入足量盐酸,充分反应后,过滤、洗涤、干燥 |
|
| 6. 选择题 | 详细信息 |
|
室温时,下列物质的溶液中,能用铝制容器盛装的是 A. KOH溶液 B. 稀H2SO4溶液 C. 浓硝酸 D. 白醋 |
|
| 7. 选择题 | 详细信息 |
|
现有NH4Cl、MgSO4、(NH4)2SO4 和NaCl四种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是 A. NaOH B. Ba(OH)2 C. AgNO3 D. HCl |
|
| 8. 选择题 | 详细信息 |
|
下列各离子组能大量共存的是( ) A. C. |
|
| 9. 选择题 | 详细信息 |
|
在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是 A. 水、氢氧化钾溶液、稀盐酸 B. 水、氢氧化钠溶液、稀盐酸 C. 水、硝酸银溶液、稀硝酸 D. 水、氢氧化钾溶液、稀硝酸 |
|
| 10. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数,下列叙述中正确的是 A. 常温常压下,48gO3含有氧原子数为NA B. 标准状况下,1.8g的H2O中含有的电子数为NA C. 常温常压下,11.2L氧气所含的原子数为NA D. 2.8g铁与足量盐酸反应失去的电子数为0.15NA |
|
| 11. 选择题 | 详细信息 |
|
下列说法不正确的是 A. SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 B. 石英坩埚不能用来熔融纯碱固体 C. 因SiO2不溶于水,故SiO2不是酸性氧化物 D. 氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸 |
|
| 12. 选择题 | 详细信息 |
下图中能较长时间看到Fe(OH)2白色沉淀的是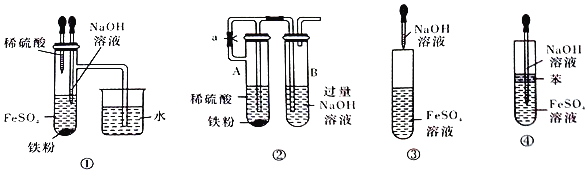 A. ① B. ①② C. ①②③ D. ①②④ |
|
| 13. 选择题 | 详细信息 |
|
下列叙述中正确的是( ) A. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 B. 液溴易挥发,在存放液溴的试剂瓶中应加水封 C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- D. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
|
| 14. 选择题 | 详细信息 |
|
发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭。该火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为: A. 此反应是氧化还原反应 B. 反应瞬间产生大量高温气体,推动火箭飞行 C. 在此反应中 D. R的分子式为 |
|
| 15. 选择题 | 详细信息 |
如图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值等于( ) A. 2 B. 3 C. 4 D. 5 |
|
| 16. 选择题 | 详细信息 |
|
下列说法正确的是( ) ①氯气的性质活泼,它与氢气混合后立即发生爆炸 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 ③新制氯水的氧化性强于久置氯水 ④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水 A. ①②③ B. ②③④ C. ③ D. ③⑤ |
|
| 17. 选择题 | 详细信息 |
|
认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法中正确的是 A. 镁在空气中或纯净氧气中燃烧的产物都只有MgO B. 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 C. 将四氧化三铁溶解于过量的硝酸中,所得溶液中含有Fe3+、Fe2+ D. 氯化铝和过量的氨水反应一定得到Al(OH)3沉淀 |
|
| 18. 选择题 | 详细信息 |
|
某学习小组为了探究碳酸钠溶液与盐酸的反应,将等体积的a mol/LNa2CO3溶液和b mol/L盐酸相互滴加混合,收集的气体体积大小关系为: V1>V2>0。下列有关说法正确的是 A. V1是盐酸滴入到碳酸钠中产生的气体 B. a=b C. 2a>b>a D. 2a=b |
|
| 19. 选择题 | 详细信息 |
|
下列有关铁及其化合物的说法中正确的是 A. Fe3+与KSCN 产生血红色沉淀 B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2 C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤 D. 赤铁矿的主要成分是Fe3O4 |
|
| 20. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 A. 金属铝溶于氢氧化钠溶液: Al+2OH-=AlO2-+H2↑ B. 过量的铁粉与稀硝酸反应: Fe+4H++NO3-==Fe3++NO↑+2H2O C. 过氧化钠用作供氧剂:Na2O2+2H2O==2Na++2OH-+O2↑ D. 向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-==2Fe2++I2+6H2O |
|
| 21. 选择题 | 详细信息 |
将2.5g NaHCO3、Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是 A. OA段发生反应的离子方程式为:OH-+H+==H2O H++CO32-==HCO3- B. 当加入35mL盐酸时,产生CO2的体积为336mL C. 混合物中NaOH的质量0.6g D. A点溶液中的溶质为NaCl、NaHCO3 |
|
| 22. 选择题 | 详细信息 |
|
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 A. Na2O2中阴、阳离子的个数比为1∶1 B. Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 C. Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 D. Na2O2漂白后的有色物质受热后能恢复原色 |
|
| 23. 选择题 | 详细信息 |
|
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是 A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量 C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量 |
|
| 24. 选择题 | 详细信息 |
|
向一定量的Fe、FeO、Fe2O3,Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为 A. 0.25mol B. 0.2lmol C. 0.3mol D. 035mol |
|
| 25. 选择题 | 详细信息 |
|
向1L某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化忽略不计,则下列说法中正确的是 A. 原溶液中c(Br-)=0.4mol/L B. 反应后溶液中c(Fe3+)=c(Fe2+) C. 反应后溶液中c(Fe3+)=0.1mol/L D. 原溶液的FeBr2浓度为0.lmol/L |
|
| 26. 实验题 | 详细信息 |
|
用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。请回答下列问题: (1)配制稀盐酸时,应选用容量为____mL的容量瓶; (2)经计算需要量取______mL浓盐酸,在量取时宜选用下列量筒中的______。(填字母) A.10mL B.25mL C.50mL D.100mL (3)在量取浓盐酸后,进行了下列操作: ①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入所选用的容量瓶中。 ②往容量瓶中小心加蒸馏水至液面接近环形标线1~2cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。 ③在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。 ④用蒸餾水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。 ⑤配制完后,应将容量瓶中的稀盐酸转移到干燥洁净的试剂瓶中存放,盖好塞子并贴上标签。 上述操作中,正确的顺序是(填序号)__________________。 (4)在上述配制过程中,用刚刚用蒸馏水洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是______(填“偏高”、“偏低”、“无影响”)。若定容时,俯视刻度线,则配制的稀盐酸浓度是_______(填“偏高”、“偏低”、“无影响”)。 |
|
| 27. 实验题 | 详细信息 |
|
某同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_________________________________。 (2)甲同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为______________________。 (3)乙同学认为甲同学的实验不够严谨,该同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是__________。 (4)两同学取10ml 0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。取2mL此溶液于试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;写出发生反应的离子方程式为_________。 (5)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是______________,生成沉淀的成分是________________。 |
|
| 28. 综合题 | 详细信息 |
某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: 据此回答下列问题: (1)I、II、IV四步中对于溶液和沉淀的分离采取的方法是_________;获得沉淀后,要对沉淀进行洗涤,请简述洗涤沉淀的操作是______________________________________。 (2)根据上述框图反应关系,写出下列B、E所含物质的化学式并回答相关问题: 固体B_______;溶液液E_______;沉淀D的重要用途是__________________;KAl(SO4)2 的重要用途是_____________________________。 (3)写出写出①、②、③三个反应的离子方程式:①______;②______;③______。 |
|
| 29. 实验题 | 详细信息 | ||||||||||||||||||||||||
通常用碳在高温下还原二氧化硅制得粗硅,粗硅(合铁、铝、硼、磷等杂质) 与氯气反应生成四氯化硅(反应温度450-500℃),四氧化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。(D的硬质玻璃管中盛装粗硅) 相关信息如下: a.四氧化硅遇水极易反应生成硅酸和氯化氢; b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物; c.有关物质的物理常数见下表:
|
|||||||||||||||||||||||||
| 30. 综合题 | 详细信息 |
|
现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液。现做如下实验: ①取440mL甲溶液与120mL乙溶液反应,产生1.56g沉淀。 ②取120mL甲溶液与440mL 乙溶液反应,产生1.56g 沉淀。 ③取120mL 甲溶液与400乙溶液反应,产生3.12g沉淀。 通过必要的计算和推理判定: (1)甲溶液为_____溶液(填化学式),其物质的量浓度是_______mol/L。 (2)乙溶液为_______溶液(填化学式),其物质的量浓度是________mol/L。 |
|
最近更新



