广东省惠州市惠城区惠州市第一中学教育集团2020-2021年九年级前半期12月月考化学题免费在线检测
| 1. 选择题 | 详细信息 |
|
由“丝绸之路”到“一带一路”是一个时空的跨越,它促进了东西方经济、文化的交流。下列 中国发明中不属于化学变化的是( ) A. 雕刻木质印字活板 B. 使用火药 C. 粮食酿酒 D. 冶炼金属 |
|
| 2. 选择题 | 详细信息 |
|
下列有关空气的叙述中正确的是( ) A. 空气中氮气的质量约占78%,氧气的质量约占 21% B. 目前计入空气污染指数的项目有 SO2、CO2、NO2 C. 空气的成分是固定不变的 D. 空气主要由氮气、氧气组成,还含有少量稀有气体、二氧化碳和其他气体及杂质 |
|
| 3. 选择题 | 详细信息 |
|
地壳中含量最多的金属元素,非金属元素和空气中含量最多的元素组成的化合物是 A. Al(NO3)3 B. CaCO3 C. Al2(SO4)3 D. Fe(NO3)3 |
|
| 4. 选择题 | 详细信息 |
元素周期表是学习和研究化学的重要工具,可以从表中 获得许多信息,下表是元素周期表的一部分,有关推断正确的是( ) A.①代表的是碳元素,化学性质很活泼 B.元素②的原子容易得到两个电子 C.元素②和④组成物质的化学式为 MgCl D.元素③与氮元素的化学性质相似 |
|
| 5. 选择题 | 详细信息 |
|
下列对生活常见现象的解释不合理的是( ) A. 红墨水在热水中比冷水中扩散得快 —— 温度越高,分子运动越快 B. 公园里柳絮纷飞 —— 分子在不停地运动 C. 瘪的乒乓球放到热水中会鼓起来 —— 分子间存在间隙 D. 糖甜盐咸 — 不同的分子具有不同的性质 |
|
| 6. 选择题 | 详细信息 |
|
下列化学实验基本操作中正确的是() A.量取8.5ml的液体可用10mL的量筒 B.称量氢氧化钠固体时,要放在称量纸上 C.可以在量筒中配制溶液 D.试管、烧杯、蒸发皿等仪器可在酒精灯火焰上直接加热 |
|
| 7. 选择题 | 详细信息 |
|
A.-2 B.+2 C.+4 D.+6 |
|
| 8. 选择题 | 详细信息 |
|
下列关于Na、Na+两种粒子的判断:①核电荷数相同;②核外电子数相等;③电子层结构完全相同;④质量几乎相等;⑤质子数相等;⑥Na+比Na稳定。其中正确的是( ) A.①④⑤⑥ B.①③⑤⑥ C.①④⑤ D.②③④ |
|
| 9. 选择题 | 详细信息 |
|
下列实验设计不能达到目的的是( ) A.制取纯净水 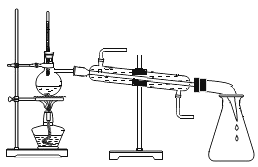 B.检验蜡烛燃烧生成二氧化碳 B.检验蜡烛燃烧生成二氧化碳 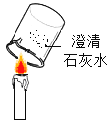 C.验证分子不断运动 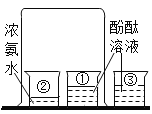 D.常温下制取并收集一瓶氧气 D.常温下制取并收集一瓶氧气 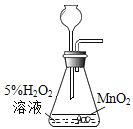 |
|
| 10. 选择题 | 详细信息 |
电解水的示意图,下列说法符合事实的是( ) A.图中 C.该实验说明水里有氢气和氧气 D.负极与正极产生气体的质量比是 2:1 |
|
| 11. 选择题 | 详细信息 |
|
运用下列方法或试剂区分各组物质,难以达到目的的是( ) A. 燃着的木条——氧气和氢气 B. 闻气味——二氧化硫和二氧化碳 C. 观察颜色——木炭粉和二氧化锰 D. 肥皂水——软水和硬水 |
|
| 12. 选择题 | 详细信息 |
某化学兴趣小组设计了如图所示的实验装置,用于“测定空气中氧气的含量”(试管的容积为20mL,注射器的活塞实验前停在20mL处,容器内红磷足量)。用酒精灯加热装置中的红磷,充分反应直至燃烧结束,试管冷却,可观察到装置中活塞最终停留的接近刻度是()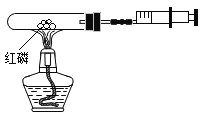 A.8mL处 B.12mL 处 C.14mL处 D.16mL处 |
|
| 13. 选择题 | 详细信息 | |||||||||||||||
如在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应, 测得反应前后各物质质量如下表。关于此反应,下列认识正确的是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
今有A、B两质量相等的固体,其中A为纯氯酸钾,B是氯酸钾和二氧化锰的混合物,在酒精灯上同时加热,均完全反应,得到的气体量与时间的关系图正确的是( ) A. 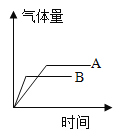 B. B.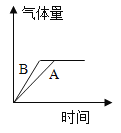 C. 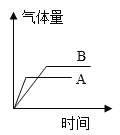 D. D. |
|
| 15. 填空题 | 详细信息 |
|
化学用语是学习化学的基本工具,请用化学用语填空: (1)氯化钠中的阴离子_____; (2)2 个铵根离子_____; (3)标出氧化镁中镁元素的化合价_____; (4)如果用“●”表示一个氢原子,请用“●” 画出 H2的微观示意图_____。 |
|
| 16. 流程题 | 详细信息 |
今年国庆假期,小明从南湖带回一瓶浑浊的湖水,他在化学实验室模拟自来水厂的净水过程,最终制成蒸馏水,流程如图所示: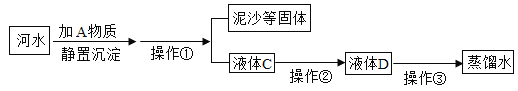 (1)操作①的名称是_____,实验室进行该操作时需要用到的玻璃仪器为玻璃棒、烧杯和_____; (2)操作②主要是活性炭的_____性除去一些异味和色素;操作③属于_____变化(填“物理”或“化学”); (3)取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明是_____(填“硬水”或“软水”),生活中硬水软化采用_____的方法。 |
|
| 17. 填空题 | 详细信息 |
|
预防新型冠状病毒除了戴口罩、勤洗手,还要做好消毒工作。请按要求填空: (1)口罩成为每个人的生活必需品,医用口罩生产中采用环氧乙烷灭菌消毒。环氧乙烷的化学式为 C2H4O,环氧乙烷由_____种元素组成,环氧乙烷分子中碳、氢、氧原子的个数比为_____,环氧乙烷中碳元素的质量分数为_____(结果保留至 0.1%)。 (2)如图是酒精完全燃烧的微观示意图。  ①该反应中乙和丁的质量比是_____(填最简整数比)。 ②酒精易挥发且易燃,挥发是因为(从微观上解释) _____。 |
|
| 18. 实验探究题 | 详细信息 |
化学实验操作期中考试有两个考题:①二氧化碳的制取、收集和验满,②氧气的制取、收集和验满。考试的方法是由考生抽签确定考题,小明抽签后被老师引导至准备了下列仪器和药品的实验台前: 请回答:(1)由实验台上提供的仪器和药品,你认为小明抽到的考题是_____(填写实验编号)。若可自由选择药品,只提供上图的仪器,还可制取其它气体,化学方程式为_____; (2)以下是小明完成该实验主要操作过程如下示意图,按评分标准,每项操作正确得 1 分,满分 5 分,实验完毕后小凯得了 3 分。请写出他失分的 2 个错误:_____,_____。 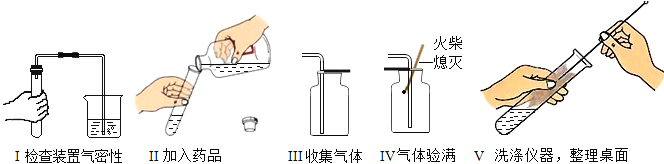 |
|
| 19. 实验探究题 | 详细信息 |
实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题。 (1)仪器 a 的名称为_____。小红选用 C 装置制取某气体,将仪器 a 换成了注射器,这样改变的优点是_____; (2)氨气通常情况下是无色、有刺激性气味的气体,密度比空气小,极易溶于水。实验室常用加热熟石灰和氯化铵固体混合物的方法制取氨气,选用的发生装置为_____,若用 G 装置收集氨气,植物油的作用是_____; (3)小花用报废试管设计了制取 CO2的发生装置 H,该设计除了废物利用的优点外,请另写一个优点_____。 |
|
| 20. 科学探究题 | 详细信息 | |||||||||
|
同学们在研究氧气性质时,进行了硫在氧气中燃烧的实验,观察到硫在氧气中燃烧时发出_____色火焰,放出热量,生成一种有刺激性气味的气体,化学方程式为_____。该实验说明氧气具有助燃性。小明在阅读相关资料时,发现二氧化氮(NO2)也具有助燃性。他决定利用如下实验进行探究。 (提出问题)二氧化氮是否具有助燃性? (查阅资料)①蓝色的硝酸铜固体在加热条件下分解,化学方程式为: ②通常状况下,NO2是一种红棕色气体,相同状况下,其密度大于氧气的密度,在低于室温时变成液态。 (实验过程)实验装置如图,实验现象:试管内蓝色固体逐渐变成_____色,有红棕色气体生成,带火星的木条_____;  实验结论:二氧化氮具有助燃性。 (反思与评价)小刚认为小明的实验不能证明 NO2具有助燃性,其理由是_____。 小刚认为利用补充如下实验可以证明 NO2具有助燃性: (实验改进)
|
||||||||||
| 21. 流程题 | 详细信息 |
西藏日喀则光伏工程是西藏目前最大的光伏电站,也是为西藏和平解放 60 周年献礼的重点工程。该工程总装机总规模达 30 兆瓦,太阳能光伏发电最关键的材料是高纯硅,生产高纯硅的流程如下,请回答下列问题: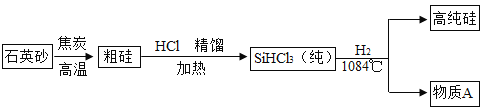 (1)整个制备过程必须达到无水无氧。在 H2还原 SiHCl3过程中若混入 O2,可能引起的后果是_____; (2)多晶硅生产过程中的一个重要反应为 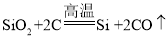 ,体现出了碳具有_____性;写出一条利用碳的这个性质冶炼金属的化学方程式_____。 ,体现出了碳具有_____性;写出一条利用碳的这个性质冶炼金属的化学方程式_____。 |
|
| 22. 推断题 | 详细信息 |
下图表示某些物质间转化关系(部分反应条件和生成物已省略)。其中 A 为铜绿 Cu2(OH)2CO3,在加热时会分解生成 B、C、D 三种常见的氧化物,B 为黑色固体,C 为无色液体,D 为无色气体,能使澄清石灰水变浑浊。 请回答: (1)B 物质是_____(填名称),物质E是 _____(填化学式); (2)反应①的反应类型为_____反应; (3)写出反应②的化学方程式:_____; (4)③在自然界的绿色植物中普遍存在,称为_____作用。 |
|
| 23. 计算题 | 详细信息 |
为测定一瓶标签破损(如图)的钙片中碳酸钙的含量,某同学做了如下实验:取 20 片钙片,放入干燥、洁净的烧杯中,然后逐滴滴加稀盐酸,当加入 100g 盐酸后,恰好完全反应,此时称量烧杯内剩余物质的总质量为 131.2g 。 (钙片中其他成分不和稀盐酸反应,反应中产生的气体全部放出)。 (1)反应生成了二氧化碳气体_____g。 (2)该钙片中碳酸钙的质量分数是多少?(写出计算过程) (3)1 片钙片中含钙元素的质量为_____g。 |
|
最近更新




