广西试卷带答案和解析
| 1. 选择题 | 详细信息 |
2015年3月3日,台州某医药化工园区内一家化工企业发生液溴泄漏。液溴有毒,有强腐蚀性。某环保小组人员用试剂瓶收集液溴,则该试剂瓶上应贴有的标签是( ) A.①② B.①③ C.③④ D.③⑤ |
|
| 2. 选择题 | 详细信息 | ||||||||||||
下列实验中,所选装置或实验设计合理的是
|
|||||||||||||
| 3. 选择题 | 详细信息 |
|
下列除去杂质的操作方法错误的是( ) A.氧化镁中含少量氧化铝:加足量氢氧化钠溶液充分搅拌后过滤 B.氢气中含少量氯化氢:通入装有氢氧化钠溶液的洗气瓶 C.自来水中含少量Fe3+:蒸馏 D.硝酸钾固体中含少量氧化钾:配制80 ℃的饱和溶液,冷却、结晶、过滤、洗涤、干燥 |
|
| 4. 选择题 | 详细信息 |
|
下列实验方案设计中,可行的是( ) A.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉 B.用萃取的方法可将汽油和煤油进行分离 C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物 D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气 |
|
| 5. 选择题 | 详细信息 |
|
下列叙述中正确的是( ) A. 任何条件下氯化氢气体的密度都小于二氧化氮 B. 2.3 g 钠与1.12 L 氯气反应后,生成5.85 g 氯化钠 C. 常温常压下,1 g氦气和1 g氧气的体积比为2∶1 D. 在同温同体积时,气体物质的物质的量越大,压强越大 |
|
| 6. 选择题 | 详细信息 |
|
同温同压下,等物质的量的一氧化氮和二氧化氮气体具有相同的( ) A. 氧原子数 B. 原子数 C. 质量 D. 体积 |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.1mol任何气体所占体积都约为22.4L B.1mol H2O在标准状况下体积为22.4L C.1mol气体体积为22.4L,则一定是标准状况 D.气体摩尔体积不一定是22.4L/mol |
|
| 8. 选择题 | 详细信息 |
|
现有三组溶液:①汽油和氯化钠溶液②39%的乙醇溶液③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( ) A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.分液、蒸馏、萃取 D.蒸馏、萃取、分液 |
|
| 9. 选择题 | 详细信息 |
|
要除掉粗盐中含有的氯化镁、硫酸镁等杂质。现设计一个除杂质的方案,把盐溶于水,过滤成澄清溶液,再进行下列各步骤的处理:①加入氯化钡溶液至沉淀完全;②用盐酸调节pH至溶液呈微酸性;③加入NaOH溶液至沉淀完全;④过滤沉淀;⑤加入碳酸钠溶液至沉淀完全;⑥蒸发浓缩使NaCl晶体析出。对上述各处理步骤的顺序安排合理的是 A.①②③④⑤⑥ B.③①⑤④②⑥ C.②①③④⑤⑥ D.②③⑤④①⑥ |
|
| 10. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数,则下列叙述中正确的是 A. 6.02×1022个H2SO分子在水中可电离生成2NA个H+ B. 在0℃、101kPa时,22.4L氢气中含有NA个氢原子 C. 14g氮气中含有7NA个电子 D. NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4 |
|
| 11. 选择题 | 详细信息 |
|
给出下列条件,无法确定该物质摩尔质量的是( ) A.已知气体在标准状况时的密度 B.已知物质的体积和质量 C.已知一定量物质的质量和物质的量 D.已知物质一个分子的实际质量 |
|
| 12. 选择题 | 详细信息 |
|
下列各组溶液,不用其他试剂就可以将它们区别开的是( ) A.HCl、KOH、K2SO4、K2CO3 B.NaNO3、BaCl2、Na2CO3、NaOH C.BaCl2、CaCl2、Na2SO4、KNO3 D.KOH、K2CO3、MgSO4、H2SO4 |
|
| 13. 选择题 | 详细信息 |
|
除去下列溶液中的杂质(括号内的物质),下列做法不正确的是( ) A.NaCl溶液(BaCl2),加Na2SO4溶液,过滤 B.KNO3溶液(AgNO3),加NaCl溶液,过滤 C.NaCl溶液(I2),加四氯化碳,分液 D.KNO3溶液(I2),加四氯化碳,分液 |
|
| 14. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为 B.从1L C.配制480mL D.中和100mL |
|
| 15. 选择题 | 详细信息 |
|
物质的量浓度相同的NaCl、.MgCl2、AlCl3 三种溶液,当溶液的体积比为3:2:1时,三种溶液中Cl-的物质的量之比为( ) A.1:1:1 B.1:2:3 C.3:2: 1 D.3:4:3 |
|
| 16. 选择题 | 详细信息 |
|
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,该溶液的密度为ρ g·cm-3,质量分数为w,其中含 A.溶质的质量分数w= B.溶质的物质的量浓度c= C.溶液中c( D.上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w |
|
| 17. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数的值,下列说法中正确的是( ) A. 含0.1mol BaCl2的溶液中Cl-数为0.1NA B. 22gCO2所含有的分子数为0.5NA C. 11.2LCO2所含有的分子数为0.5NA D. 常温下NA个Cl2分子所占有的体积为22.4L |
|
| 18. 选择题 | 详细信息 |
|
在标准状况下,质量为m的气体A与质量为n的气体B的分子数相同,下列说法中不正确的是( ) A.气体A与气体B的相对分子质量比为m:n B.同质量气体A与气体B的分子个数比为n:m C.同温同压下,A气体与B气体的密度比为n:m D.相同状况下,同体积的A气体与B气体的质量比为m:n |
|
| 19. 选择题 | 详细信息 |
|
36.5gHCl溶解在1L水中(水的密度近似为1 gmL-1),所得溶液的密度为ρ gmL-1,质量分数为w,物质的量浓度为c gmL-1,NA表示阿伏加德罗常数,下列说法正确的是( ) A.所得溶液的物质的量浓度:c=1 gmL-1 B.所得溶液中含有NA个HCl分子 C.36.5 gHCl气体占有的体积为22.4L D.所得溶液的质量分数: w= |
|
| 20. 选择题 | 详细信息 | ||||||||||||
两份体积相同的某植物营养液,其配方分别如下:
|
|||||||||||||
| 21. 实验题 | 详细信息 | ||||||||||||
|
在化学实验室中进行实验,规范操作是顺利进行实验以及避免事故的保障。 (1)下列有关实验的处理方法不正确的是________(填字母)。 a.不慎碰倒酒精灯而使酒精在实验桌上燃烧起来,应立即用水浇灭 b.实验时手指不小心沾上氢氧化钠浓溶液,立即用稀硝酸冲洗 c.制取的氧气用排水法收集时,若出现倒吸,应立即松开试管上的橡皮塞 d.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 (2)请将下列实验中的错误操作可能引起的不良后果填在表格中。
(3)下列关于不进行气密性检查可能导致的后果的叙述中,正确的是________(填字母)。 |
|||||||||||||
| 22. | 详细信息 |
某化学兴趣小组设计下列流程将含铁废铝制备成硫酸铝晶体。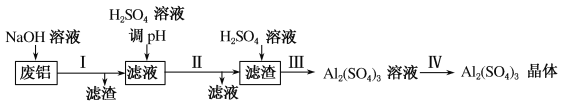 回答以下问题: (1)上述流程中用到如图所示装置。  ①上图装置A中的错误之处是______;两装置均用到的玻璃仪器是______,该仪器在A中的作用是_______,在B中的作用是________。 ②上述流程中用到装置A的操作是步骤_________(填“Ⅰ”“Ⅱ”“Ⅲ或“Ⅳ”,下同),用到装置B的操作是步骤___________,装置B操作过程中,当___________时,应撤去酒精灯。 (2)向步骤I的滤液中加硫酸调节溶液的pH=8~9时,有氢氧化铝沉淀生成,检验沉淀是否完全的方法是___________。 |
|
| 23. 实验题 | 详细信息 | ||||
|
实验室用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸。 (1)所需仪器除了玻璃棒、烧杯、胶头滴管 、量筒外,还需要哪个仪器才能完成该实验,请写出:___________。 (2)计算所需浓硫酸的体积为________ mL 。现有①10mL ②50mL ③100mL三种规格的量筒,应当选用___________。(填序号) (3)实验中两次用到玻璃棒,其作用分别是:___________、__________。 (4)下列对容量瓶及其使用方法的描述中正确的是_____。
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有_______。(填序号) |
|||||
| 24. 计算题 | 详细信息 |
|
O2和O3是氧元素的两种单质,根据其分子式完成下列各题: (1)等质量的O2和O3所含分子个数比为____,原子个数比为_____,分子的物质的量之比为____。 (2)等温等压下,等体积的O2和O3所含分子个数比为___,原子个数比为_____,质量比为___。 (3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__(用含NA的式子表示)。 (4)配制100 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为____ mL。 |
|
| 25. 实验题 | 详细信息 |
欲用含有少量氯化钙的氯化钠固体,配制100 mLamol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题: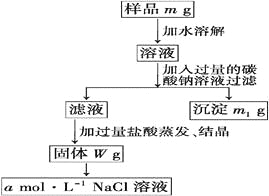 (1)称量粗盐样品mg,在托盘天平左盘上放__________________,右盘上放__________________。 (2)过滤时,漏斗下端管口应________,漏斗中液面应____________________________。 (3)蒸发操作时应将液体放在________中加热,等加热至________________________时停止加热。 (4)在样品的溶液中加入过量的Na2CO3溶液,作用是_______________,反应的化学方程式是_____________。 (5)在滤液中加入盐酸的作用是________________,反应的化学方程式是 ______________________。 (6)配制100 mLamol/L的NaCl溶液时,应从Wg固体中称取NaCl的质量为________,配制时应在____________________中进行定容。 |
|
最近更新