浙江2020年高一化学下半年月考测验带参考答案与解析
| 1. 选择题 | 详细信息 |
|
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich等人为此获得2002年诺贝尔化学奖.下面有关13C、15N叙述正确的是 A.13C与15N有相同的中子数 B.13C与C60互为同素异形体 C.15N与14N互为同位素 D.15N的核外电子数与中子数相同 |
|
| 2. 选择题 | 详细信息 |
|
能源与人类的生活和社会发展密切相关,下列关于能源开发和利用的说法中,你认为说法不正确的是 A. 充分利用太阳能 B. 因地制宜开发利用风能、水能、地热能、潮汐能 C. 合理、安全开发利用氢能、核能 D. 能源都是通过化学反应获得的 |
|
| 3. 选择题 | 详细信息 |
|
下列物质中,属于高分子化合物的是 A.油脂 B.葡萄糖 C.蛋白质 D.乙酸 |
|
| 4. 选择题 | 详细信息 |
|
下列反应属于吸热反应的是 A.稀硫酸与氢氧化钾溶液反应 B.碳与二氧化碳的反应 C.锌与稀硫酸的反应 D.生石灰变成熟石灰的反应 |
|
| 5. 选择题 | 详细信息 |
|
下列与有机物有关的说法,错误的是( ) A. 石油的裂化和裂解属于化学变化而煤的液化、气化属于物理变化 B. 甲烷、苯、乙酸乙酯、油脂都可以发生取代反应 C. 鸡蛋清溶液中加入饱和硫酸铵会产生白色沉淀,该沉淀还可以重新溶解于水中 D. “地沟油”禁止食用,但可以用来制肥皂 |
|
| 6. 选择题 | 详细信息 |
|
地壳中含量最多的元素在周期表中的位置是 A.第二周期VIA族 B.第二周期IVA族 C.第三周期VIA族 D.第三周期IVA族 |
|
| 7. 选择题 | 详细信息 |
|
下列说法中错误的是 ( ) A.化学反应中的能量变化通常表现为热量的变化 B.化学键的断裂和形成是化学反应中能量变化的主要原因 C.需要加热才能发生的反应一定是吸热反应 D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
|
| 8. 选择题 | 详细信息 |
|
下列反应不属于取代反应的是 A.CH4+Cl2 B. C.CH3CH2OH+HBr→CH3CH2Br+H2O D.CH2=CH2+HBr→CH3CH2Br |
|
| 9. 选择题 | 详细信息 |
|
下列有关化学用语表示正确的是 A.中子数为10的氧原子: B.Mg2+的结构示意图: C.硫化钠的电子式: D.乙烯的结构简式:CH2CH2 |
|
| 10. 选择题 | 详细信息 |
|
下列化学键类型相同晶体类型也相同的是 A. 晶体SiO2与干冰 B. NaCl与HCl C. 金刚石和C60 D. NH4Cl与NaOH |
|
| 11. 选择题 | 详细信息 |
|
下列关于原电池的叙述中正确的是 A.正极和负极必须是两种不同的金属 B.电子流入的一极为正极 C.原电池工作时,正极和负极上发生的都是氧化还原反应 D.原电池工作时,实现了将电能转化为化学能 |
|
| 12. 选择题 | 详细信息 |
|
温度为500℃时,反应4NH3+5O2 A.v(O2)=0.01mol/(L•s) B.v(NO)=0.08mol/(L•s) C.v(H2O)=0.0013mol/(L•s) D.v(NH3)=0.002mol/(L•s) |
|
| 13. 选择题 | 详细信息 | |||||||||
如表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍。下列说法正确的是
|
||||||||||
| 14. 选择题 | 详细信息 |
|
下列叙述中不正确的是 A.原子半径:O>S>Cl B.还原性:Na>Mg>Al C.稳定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO4 |
|
| 15. 选择题 | 详细信息 |
|
若将等物质的量的 CO 和 H2 混合气体充入恒温恒容密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),下列事实能说明此反应已达到平衡状态的是 A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变 C.生成 CH3OH 的速率与生成 H2 的速率相等 D.CO和H2的速率之比为1:2 |
|
| 16. 选择题 | 详细信息 |
下图是氢氧燃料电池的装置示意图,有关说法正确的是: A. 该装置工作时是将电能转化成了化学能 B. 该装置工作时,通入的氢气发生还原反应 C. 该装置工作时,通入氢气的一极为正极 D. 该装置工作时,电子从通入H2的一极通过导线流向通入氧气的一极 |
|
| 17. 选择题 | 详细信息 |
下图是某课外活动小组设计的用化学电池使LED灯发光的装置。下列说法错误的是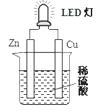 A. 铜片表面有气泡生成 B. 装置中存在“化学能→电能→光能”的转换 C. 溶液中的阳离子向正极移动,阴离子向负极移动 D. 如果将铜片换成铁片,电路中的电流方向将改变 |
|
| 18. 选择题 | 详细信息 |
|
已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( ) A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1 B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1 C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1 D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1 |
|
| 19. 选择题 | 详细信息 |
|
等质量的下列烃完全燃烧时,消耗氧气最多的是( ) A. CH4 B. C2H6 C. C3H6 D. C6H6 |
|
| 20. 选择题 | 详细信息 |
|
在分液漏斗中,分别加入溴水和苯,充分振荡、静置后,溴水层颜色变浅,是因为发生了 A. 加成反应 B. 萃取作用 C. 取代反应 D. 氧化反应 |
|
| 21. 选择题 | 详细信息 |
|
下列说法错误的是 A. 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 B. 含C18以上烷烃的重油经过催化裂化可以得到汽油 C. 煤是由有机物和无机物组成的复杂的混合物 D. 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
|
| 22. 选择题 | 详细信息 |
|
下列说法正确的是 A.油脂皂化反应得到高级脂肪酸与甘油 B.油脂、纤维素、蛋白质均可以水解, 但只有纤维素和蛋白质是高分子化合物 C.蛋白质是天然高分子,可在体内转化为氨基酸,这个过程称为蛋白质变性 D.向淀粉溶液中加入硫酸溶液,加热一段时间,然后加入过量NaOH溶液,再滴入几滴碘水,溶液未变蓝,说明淀粉已完全水解 |
|
| 23. 选择题 | 详细信息 |
乙醇分子结构中各种化学键如图所示: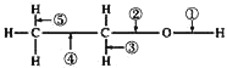 关于乙醇在各种反应中断键的说法不正确的是 A.与乙酸反应生成乙酸乙酯时,键①断裂 B.在铜催化下和氧气反应时,键①⑤断裂 C.与金属钠反应时,键①断裂 D.乙醇燃烧时,键①②③④⑤都会断裂 |
|
| 24. 选择题 | 详细信息 |
|
苯分子中不存在C—C键和C=C键交替结构,下列事实不能说明的是 A.苯不能使酸性高锰酸钾溶液褪色 B.苯分子中碳碳键的键长都相等 C.苯在加热和催化剂存在条件下与氢气反应生成环己烷 D.苯能与液溴发生取代反应,但不能与溴水发生加成反应 |
|
| 25. 填空题 | 详细信息 |
|
对下列物质进行分类(均填序号)。互为同素异形体的是_______;互为同分异构体的是_______;互为同系物的是________. ①16O 和18O ②12C60与13C70③O2和O3 ④CH3CH2OH和CH3OCH3⑤正戊烷和异戊烷⑥ CH4和CH3CH2CH2CH3⑦ 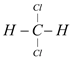 和 和 ;⑧H2O与H2O2⑨金刚石与水晶 ;⑧H2O与H2O2⑨金刚石与水晶 |
|
| 26. 填空题 | 详细信息 |
|
请写出以下物质或微粒的电子式: ①HCl___________________ ②NH3__________ ③NaOH____________ |
|
| 27. 填空题 | 详细信息 |
| 短周期元素形成的最高价氧化物的水化物酸性最强的是___________。 | |
| 28. 填空题 | 详细信息 |
|
1g氢气完全燃烧生成液态水放出143kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ热量。 (1)写出氢气燃烧的热化学方程式__________ (2)若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为__890kJ(填“>”、“<”、“=”) |
|
| 29. 填空题 | 详细信息 |
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A、B、C均为气体)。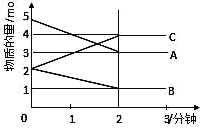 (1)该反应的的化学方程式为______________; (2)反应开始至2分钟时,B的平均反应速率为______________; (3)能说明该反应已达平衡状态的是_________。 A.v(A)=2v(B) B.v逆(A)=v正(C) C.容器内混合气体密度保持不变 D.容器内压强保持不变 |
|
| 30. 填空题 | 详细信息 |
|
写出下列有机化学反应的化学方程式。 (1)乙烯通入溴的四氯化碳溶液中:_____________。 (2)苯、浓硫酸与浓硝酸混合在50-60℃的水浴中加热:________。 (3)乙醇在铜作催化剂、加热的条件下与氧气的反应:__________。 (4)乙酸乙酯与氢氧化钠溶液反应:_________。 |
|
| 31. 实验题 | 详细信息 |
如图是用于制备乙酸乙酯的常见简易装置。请根据该装置回答下列问题: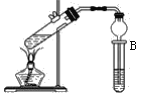 (1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先向试管中加入一定量的________,然后边振荡边缓缓加入________,冷却后再加入一定量的冰醋酸,轻轻振荡使之混合均匀。 (2)制备乙酸乙酯的化学反应方程式为_______。生成的乙酸乙酯,其密度比水_____(填“大”或“小”)。 (3)浓硫酸的作用是____________。 (4)试管B内装入饱和碳酸钠溶液,写出除去乙酸时发生反应的化学方程式_________。 (5)与书中采用的实验装置的不同之处是本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了溶液中。在此处球形干燥管的作用有________。 |
|
| 32. 计算题 | 详细信息 |
|
有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题: (1)2.3 g A中所含氢原子、碳原子的物质的量各是多少_____? (2)通过计算确定该有机物的分子式_____。 |
|
最近更新



