云南高一化学期末考试(2019年下学期)完整试卷
| 1. 选择题 | 详细信息 |
|
关于氯化钠焰色反应实验操作的描述中,不正确的是( ) A. 取一根用盐酸洗净的铂丝,放在酒精灯火焰上灼烧至无色 B. 用灼烧后的铂丝蘸取少量氯化钠溶液,放在酒精灯火焰上灼烧 C. 透过蓝色钴玻璃片观察氯化钠灼烧的火焰为黄色 D. 实验后,要用盐酸把铂丝洗净 |
|
| 2. 选择题 | 详细信息 |
|
下列有关叙述正确的是( ) A. 电泳现象可证明胶体带电荷 B. 直径在1~100 nm之间的粒子称为胶体 C. 是否具有丁达尔效应是溶液和胶体的本质区别 D. 胶体粒子很小,可以透过滤纸 |
|
| 3. 选择题 | 详细信息 |
|
下列变化中只有通过还原反应才能实现的是 A. Fe3+→Fe2+ B. Mn2+→ C. Cl-→Cl2 D. N2O3→HNO2 |
|
| 4. 选择题 | 详细信息 |
|
关于二氧化硫和二氧化碳的下列说法中不正确的是( ) A. 都是酸性氧化物 B. 都具有氧化性 C. 都能使澄清石灰水变浑浊 D. 都能与氯化钙溶液反应生成沉淀 |
|
| 5. 选择题 | 详细信息 |
|
下列各图所示装置的气密性检查中,漏气的是 A.  B. B. C. C. D. D. |
|
| 6. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数,下列说法中正确的是( ) A. 18 g H2O所含的分子数为NA B. 22.4 L H2O所含的分子数为NA C. NA个氢原子的质量为2 g D. 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl﹣ |
|
| 7. 选择题 | 详细信息 |
|
下列物质中只含有氯分子的是( ) A. 氯水 B. 液氯 C. 盐酸 D. 食盐 |
|
| 8. 选择题 | 详细信息 |
|
关于氯的叙述中,下列正确的是( ) A. 氯气是一种黄绿色、有毒的气体 B. 氯元素在自然界中既可以以化合态存在,也可以以游离态存在 C. 氯气可用向下排空气法收集 D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物 |
|
| 9. 选择题 | 详细信息 |
|
汉代器物上的颜料“汉紫”的成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法不正确的是( )。 A. 用盐的形式表示:BaSiO3·CuSiO3 B. 用氧化物形式表示:BaO·CuO·2SiO2 C. 易溶于强酸、强碱 D. 性质稳定,不易褪色 |
|
| 10. 选择题 | 详细信息 |
|
检验某一溶液中是否含有氯离子,可选用的试剂是 A. 硝酸银溶液 B. 稀盐酸酸化的硝酸银溶液 C. 稀硝酸酸化的硝酸银溶液 D. 稀硫酸酸化的硝酸银溶液 |
|
| 11. 选择题 | 详细信息 |
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( ) A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 C. YX2晶体熔化、液态WX3气化均需克服分子间作用力 D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
|
| 12. 选择题 | 详细信息 |
|
下列关于化学反应限度的叙述中错误的是( ) A. 不同的化学反应,限度可能不同 B. 可以通过改变温度来控制化学反应的限度 C. 可以通过延长反应时间来改变化学反应的限度 D. 催化剂不能改变化学反应的限度 |
|
| 13. 选择题 | 详细信息 |
|
大理石装修的房屋彰显富丽堂皇,但当食醋不慎滴在大理石地面上时,会使其失去光泽,变得粗糙,下列能正确解释此现象的是( ) A. 食醋中的水使碳酸钙溶解 B. 食醋中的醋酸将碳酸钙氧化 C. 食醋中的醋酸起了催化作用,导致碳酸钙分解了 D. 食醋中的醋酸与碳酸钙发生了复分解反应 |
|
| 14. 选择题 | 详细信息 |
|
下列各组物质发生反应时,生成物不因反应条件(浓度、温度或催化剂等)的不同而不同的是 A. 铜与硝酸 B. 乙醇与氧气 C. 钠与氧气 D. 一氧化碳与氧气 |
|
| 15. 选择题 | 详细信息 |
|
下列化学用语正确的是( ) A. 过氧化氢的电子式: B. 异戊烷的结构简式:  C. 正丁烷的结构简式:CH3(CH2)2CH3 D. 己烷的分子式:C6H16 |
|
| 16. 选择题 | 详细信息 |
|
由甲醛(CH2O)、乙酸和乙酸乙酯组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( ) A. 27% B. 9% C. 54% D. 无法计算 |
|
| 17. 选择题 | 详细信息 |
|
各种营养素在人体内的含量都有一定的范围,过高或过低都可能影响人的正常生理机能,故应合理饮食,下列做法不科学的是( ) A. 拒绝脂肪 B. 对蛋白质要“亲疏有度” C. 科学饮食从“微量”元素做起 D. 饮食中不可缺“肠道的清道夫——纤维素” |
|
| 18. 选择题 | 详细信息 |
|
下列叙述正确的是( ) ①两种原子构成的共价化合物分子中的化学键都是极性键 ②两种不同非金属元素原子间形成的化学键都是极性键 ③含有非极性键的化合物一定是共价化合物 ④只要是离子化合物,其熔点就比共价化合物的熔点高 ⑤难失去电子的原子,易形成阴离子 ⑥单质分子中不存在化学键,化合物分子中才存在化学键 ⑦离子化合物中一定含有离子键 A. ②⑦ B. ③⑦ C. ⑦ D. ①⑤⑦ |
|
| 19. 选择题 | 详细信息 |
|
下列叙述中,不正确的是( ) A. 共价化合物中不可能含有离子键 B. 硫酸分子中有H+和SO42-两种离子 C. 某元素原子的最外层只有一个电子,它跟卤素可能形成离子键,也可能形成共价键 D. 共价键存在于非金属元素形成的化合物或单质中 |
|
| 20. 选择题 | 详细信息 |
|
化学与环境保护、工业生产、生活等密切相关。下列说法不正确的是 A. PM2.5J是指大气中直径小于或等于2.5微米的颗粒物。PM2.5比胶体粒子小,因其比表面积大,故可吸附含有铅、镉、铬、钒、砷等对人体有害的重金属离子,入肺后对人体产生很大的危害 B. 富含氮、磷的生活污水不能排放到河中,也不能直接用于农田的灌溉 C. 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染 D. 14C可用于文物的年代鉴定,14C和12C互为同位素 |
|
| 21. 选择题 | 详细信息 |
|
下列说法错误的是( ) A. 作半导体材料的元素大多数位于元素周期表中金属元素和非金属元素的交界处 B. 农药中常含有的元素通常在元素周期表的右上方区域内 C. 形成催化剂的元素通常在元素周期表的左下方区域内 D. 在元素周期表的过渡元素中寻找制作耐高温和耐腐蚀合金材料的元素 |
|
| 22. 选择题 | 详细信息 |
|
下列关于卤族元素的比较中,错误的是 A. 气态氢化物的稳定性:HF>HCl>HBr>HI B. 单质的氧化性:F2>Cl2>Br2>I2 C. 离子的还原性:F->Cl->Br->I- D. 元素的非金属性:F>Cl>Br>I |
|
| 23. 选择题 | 详细信息 |
|
门捷列夫编制的第一张元素周期表,为元素的发现和研究元素性质铺平了道路,当时门捷列夫编排元素先后顺序的依据是( ) A. 原子半径 B. 原子序数 C. 相对原子质量 D. 质子数 |
|
| 24. 选择题 | 详细信息 |
|
下列除去杂质(括号内物质为少量杂质)的方法中,正确的是 A. 乙烷(乙烯):光照条件下通入Cl2,气液分离 B. 乙酸乙酯(乙酸):用饱和碳酸钠溶液洗涤,分液 C. CO2(SO2):气体通过盛氢氧化钠溶液的洗气瓶 D. 乙醇(乙酸):加足量浓硫酸,蒸馏 |
|
| 25. 综合题 | 详细信息 |
|
利用分类法研究化学物质可系统、全面认识物质的性质。 Ⅰ.下列三组物质中,均有一种物质的类别与其他三种不同。 ①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2 (1)三种物质依次是(填化学式): ①________;②________;③________。 (2)这三种物质相互作用可生成一种新物质NaHCO3,该反应________(填“是”或“不是”)氧化还原反应。 (3)写出Na2CO3与足量稀硫酸反应的离子方程式:________________。 (4)HCO3-与H+、OH-在溶液都不能大量共存,试用离子方程式说明:_______________。 Ⅱ.现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体 (1)以上物质中能导电的是________。 (2)以上物质中属于电解质的是________,属于非电解质的是________。 (3)以上物质中,溶于水能导电的物质是________。 |
|
| 26. 填空题 | 详细信息 |
德国化学家凯库勒研究提出的苯分子结构模型如图所示: (1)请根据苯的分子结构模型,写出苯的分子式_______,结构式____________,结构简式________________。 (2)向试管中加入3 mL酸性高锰酸钾溶液,再加入1 mL苯,振荡试管。观察到的实验现象是_______________。 (3)向试管中加入1 mL溴水,再加入3 mL苯,振荡试管。观察到的实验现象是_____________。 (4)你认为凯库勒提出的苯的分子结构符合实验事实吗?________,理由是_____________。 |
|
| 27. 实验题 | 详细信息 |
海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下: (1)指出从海藻中提取I2的实验操作名称: ①____________,③__________②的离子方程式__________,。 (2)提取碘的过程中,可供选择的有机溶剂是(____)。 A 甲苯、酒精 B 四氯化碳、苯 C 汽油、乙酸 D 汽油、甘油 (3)为使海藻中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。还缺少的仪器是________。 (4)从含碘的有机溶剂中提取碘,还要经过蒸馏,指出下列蒸馏装置中的错误之处__________。  (5)进行蒸馏操作时,使用水浴加热的原因是_________________,最后晶态碘在________中。 |
|
| 28. 填空题 | 详细信息 |
|
利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白: (1)实验原理:Fe+2H+=Fe2++H2↑。 (2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品) (3)实验装置(如图)。  (4)原电池设计及注意的问题: ①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。 ②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。 |
|
| 29. 推断题 | 详细信息 |
A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系: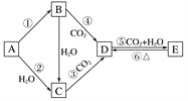 (1)推断各符号所代表的物质的化学式: A____________,B____________,C____________,D____________,E____________。 (2)分别写出反应②、⑤的化学方程式: ②______________________________________, ⑤__________________________________________。 (3)写出反应③的离子方程式____________________________________________。 |
|
| 30. 推断题 | 详细信息 |
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断: (1)写出化学式:X_______,A________,B_______。 (2)实验室收集气体D和F的方法依次是_______法、________法。 (3)写出C→E的化学方程式:____________。 (4)请写出A与E反应生成D的化学方程式:_______________ (5)检验物质A的方法和现象是________________ |
|
| 31. 推断题 | 详细信息 |
已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题: (1)操作⑥、操作⑦的名称分别为________、________。 (2)下列物质中沸点最高的是________。 A 汽油 B 煤油 C 柴油 D 重油 (3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号) (4)写出结构简式:A________、F________。 (5)写出反应③的离子方程式:___________。 (6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。 |
|
最近更新



