郑州市带答案与解析
| 1. 选择题 | 详细信息 | |||||||||||||||
下列厨房用品中的主要成分属于非电解质的是( )
|
||||||||||||||||
| 2. 选择题 | 详细信息 |
|
化学与日常生活密切相关。下列有关说法错误的是( ) A.碳纤维的性质稳定,常用作复合材料的增强体 B.Al(OH)3为两性氢氧化物,可用于治疗胃酸过多 C.BaCO3难溶于水,可用作医疗上检查肠胃的钡餐 D.高压钠灯发出的黄光射程远、透雾能力强,可用于道路照明 |
|
| 3. 选择题 | 详细信息 |
|
下列试剂在实验室中的保存方法错误的是( ) A.金属钠在煤油中密封保存 B.液溴可用少量水液封保存 C.硝酸保存在棕色试剂瓶中 D.氢氧化钠溶液保存在带有玻璃塞的试剂瓶中 |
|
| 4. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.标准状况下,22.4 L H2O中的分子数为NA B.质量相同的O2和O3,所含的氧原子数相同 C.1 L 1 mol∙L-1NaCl溶液中含有NA个NaCl分子 D.1 mol Na在空气中完全燃烧生成Na2O2,转移电子的数目为2NA |
|
| 5. 选择题 | 详细信息 |
碳元素以多种形态存在于自然界中,其化合价与物质类别间的关系如图所示。下列说法错误的是( ) A.a存在多种同素异形体 B.正常雨水的pH约为5.6,是因为含有d C.若e和f都是钙盐,热稳定性:f>e D.用同一氧化剂可实现a-b-c的转化 |
|
| 6. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A.使石蕊变蓝的溶液中:K+、Na+、CO B.无色透明的溶液中:Al3+、Cu2+、SO C.新制的氯水中:Na+,NH D.0.1mol·L-1盐酸中:Mg2+、Fe2+、NO |
|
| 7. 选择题 | 详细信息 |
|
下列离子方程式的书写正确的是( ) A.向Fe粉中加入稀H2SO4:Fe+2H+=Fe3++H2↑ B.向Al箔中加人NaOH溶液:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ C.向NaOH溶液中通入过量的CO2:2OH-+CO2=CO D.向Cu片中加入稀HNO3:Cu+4H++2NO |
|
| 8. 选择题 | 详细信息 | ||||||||||||||||||||
四支试管中分别盛放少量不同的试剂,进行如下操作,结论正确的是( )
|
|||||||||||||||||||||
| 9. 选择题 | 详细信息 |
海水中蕴藏着丰富的化学资源,海水开发利用的部分过程如图所示。下列说法错误的是( )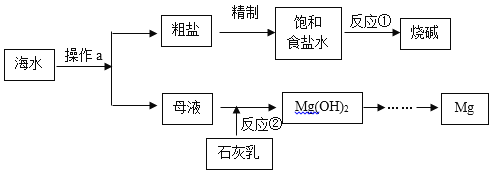 A.操作a为结晶 B.精制过程中,加入NaOH溶液可除去粗盐中的Mg2+ C.反应①为氧化还原反应,反应②为复分解反应 D.将Mg(OH)2加热分解,可以得到金属Mg |
|
| 10. 选择题 | 详细信息 | |||||||||||||||
为达到实验目的,下列实验方案错误的一项是( )
|
||||||||||||||||
| 11. 选择题 | 详细信息 |
烟气脱硝是工业废气处理中的重要工艺。活性炭吸附催化脱硝法的工艺流程如图所示。下列有关说法错误的是( )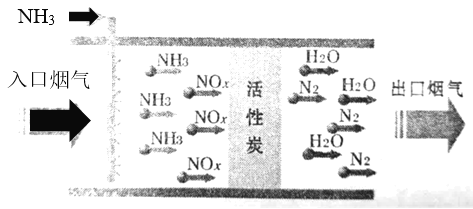 A.烟气脱硝过程中NH3做还原剂 B.该流程中的活性炭仅起到吸附作用 C.为使气体在活性炭界面充分反应,需控制气体流速 D.若x=1,则相应的化学方程式为6NO+4NH3 |
|
| 12. 选择题 | 详细信息 |
常温下,将N2和H2、Cl2的混合气体充入透明的恒容密闭容器中,中间用可自由移动的挡板隔开,如图所示。下列说法错误的是( ) A.挡板恰好位于容器的正中间 B.挡板左右两侧的气体压强相同 C.挡板左右两侧的气体原子总数相等 D.将容器光照后恢复至室温,挡板右移 |
|
| 13. 选择题 | 详细信息 |
|
我国食盐中普遍添加KIO3以防止碘缺乏症。已知KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4,下列说法错误的是( ) A.预测I2既有氧化性,又有还原性 B.反应中氧化剂与还原剂的物质的量之比为5∶1 C.每生成0.6 mol I2转移电子的物质的量为1 mol D.反应涉及到的三种含碘元素的物质中,只有I2能使淀粉溶液变蓝 |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
下表各选项中,通过置换反应不能实现由X到Y转化的一组化合物是( )
|
||||||||||||||||
| 15. 选择题 | 详细信息 |
|
取甲、乙两个相同的小烧杯,分别加入6.2gNa2O固体和7.8gNa2O2固体,再加人等体积的蒸馏水使其完全溶解。下列有关叙述正确的是( ) A.两烧杯中反应的类型相同 B.两烧杯中均有气体产生 C.反应后溶液的质量:甲<乙 D.反应后溶液的浓度:甲=乙 |
|
| 16. 选择题 | 详细信息 |
将NaCl、MgCl2、CuCl2的混合物溶于水,配制成200mL溶液,其中部分离子的浓度如图所示,下列有关说法正确的是( ) A.溶液中Na+的物质的量为1.0mol B.混合物中MgCl2的质量为0.95g C.溶液中CuCl2的物质的量浓度为1.5mol·L-1 D.NaCl、MgCl2、CuCl2物质的量之比为2:1:1 |
|
| 17. 填空题 | 详细信息 |
|
N、Si、Al的化合物常用于制作新型无机非金属材料,如SiO2可用于制作光导纤维,AlN可用于制作耐高温材料,Al2O3可用于制作生物陶瓷。 (1)光导纤维应避免与碱性物质接触,推测SiO2属于___氧化物。 (2)用氯化铝和氮气经气相反应可以制得AlN。 ①AlN中N元素的化合价为___。 ②写出实验室制取氨气的化学方程式___。 ③在水溶液中,氯化铝与氨气反应无法制得AlN,用化学方程式解释___。 (3)用铝土矿(主要成分为Al2O3)冶炼铝时,常用碱液浸取。写出Al2O3与NaOH溶液反应的离子方程式___。 |
|
| 18. 实验题 | 详细信息 |
|
实验室里有甲、乙两瓶NaOH溶液,甲瓶为100mL2.0mol·L-1NaOH溶液,乙瓶为100g7%NaOH溶液。 (1)若需判断甲、乙两瓶溶液的浓度是否相等,需要的物理量是___。 (2)实验室用NaOH固体配制两种溶液,配制甲瓶溶液比配制乙瓶溶液多出的仪器是___。 (3)配制100mL2.0mol·L-1NaOH溶液,需称量NaOH固体的质量是___。 (4)配制过程中需要“摇匀”,写出“摇匀"的具体操作___。 (5)用2.0mol·L-1的NaOH溶液吸收2.24LCl2(STP)制取简易消毒液,发生反应的化学方程式为___,若Cl2恰好被完全吸收,消耗NaOH溶液的体积为___mL。 |
|
| 19. 实验题 | 详细信息 |
电子工业常用FeCl3溶液腐蚀印刷电路板上的铜箔。某研究小组设计以下流程从腐蚀废液中回收铜,并重新获得FeCl3溶液。 (1)FeCl3溶液腐蚀铜箔的离子方程式为___。 (2)试剂①为___(写化学式),试剂②需过量的原因是___。 (3)证明“滤液”中不含Fe3+的方法为___。 (4)“反应”步骤中的离子方程式为___。 (5)向沸水中加入1mol•L-1FeCl3溶液至液体呈透明的红褐色,该分散系具有的独特性质是___(写出一条)。 |
|
| 20. 填空题 | 详细信息 |
|
宏观辨识、微观探析和符号表征是化学学习的重要方法。某化学兴趣小组设计实验,探究离子反应及氧化还原反应的本质。 I.电解质在水溶液中的反应 向0.01mol·L-1Ba(OH)2溶液中滴入几滴酚酞溶液,按如图所示连接装置,并接通电源,然后向Ba(OH)2溶液中滴加0.2mol·LH2SO4溶液。请回答下列问题:  (1)滴加H2SO4溶液前,能说明Ba(OH)2在溶液中以离子形式存在的实验现象为___。 (2)随着H2SO4溶液的滴入,可观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象可说明复分解反应类型的离子反应的微观本质是___(用具体离子描述),该反应的离子方程式为___。 II.氧化还原反应 将锋片和石疆棒用导线连接,平行放置在200mL1.0ml·L-1的硫酸铜溶液中,装置如图所示。观察到电流表指针偏转,锌片逐渐溶解,石墨棒上有红色物质析出。请回答下列问题: 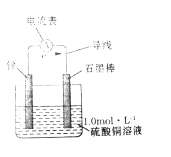 (3)已知锌片上的反应式为:Zn-2e-=Zn2+,该反应类型为___(填"氧化反应"、“还原反应”或“氧化还原反应");类比锌片上的反应,写出石墨棒上的反应式___。该实验说明氧化还原反应的本质是电子的转移。 |
|
| 21. 填空题 | 详细信息 |
|
硫及其化合物对人类的生产和生活有着重要的作用。请回答下列问题: (1)用浓硫酸配制稀硫酸时,不需要下列哪个安全防护用品_________。 a.实验服 b.防毒面具 c.橡胶手套 d.护目镜 (2)向蔗糖中滴加几滴水,再注入少量浓硫酸,用玻璃棒搅拌,蔗糖变黑并膨胀成“黑面包”,并能闻到刺激性气味。写出产生气体的化学方程式___。 (3)某化学兴趣小组设计以下实验装置,制取SO2并检验其性质。  ①装置A中发生反应的化学方程式为___。 ②依次检验SO2的漂白性、氧化性和还原性,则装置的连接顺序为A→ → → →E。___ (4)将SO2通入BaCl2溶液中,未见沉淀生成,然后通入某气体,出现白色浑浊。写出符合要求的气体的化学式___(写出两种)。 (5)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,50.00mL葡萄酒样品恰好与10.00mL0.010mol·L-1的碘标准液完全反应,其离子方程式为S2O |
|
最近更新